
【题目】化学与生活密切相关,下列有关说法正确的是 ( )
A. 糖类、蛋白质、油脂都属于天然高分子化合物
B. 油脂是产生能量最高的营养物质
C. 石油裂化的主要目的是为了获得芳香烃
D. 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分开
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________________。
(2)操作I需要的玻璃仪器主要有:烧杯、_______________,操作Ⅱ的名称是___________________。
(3)操作Ⅲ的主要过程可能是___________________________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
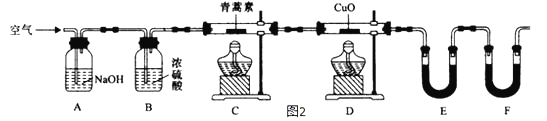
①装置E中盛放的物质是__________________,装置F中盛放的物质是____________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______________________。
③用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的最简式是_____________________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_________(填字母)具有相同的性质。
A.乙醇B.乙酸C.乙酸乙酯D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图所示:由下图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为__________________。

A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如下图所示。

试回答下列问题:
(1)顺、反式脂肪酸中所含相同官能团名称是____________。
(2)上述顺式脂肪酸的分子式为________。
(3)上述顺、反式脂肪酸不可能具备的下列化学性质是________(填序号)。
A.能使酸性高锰酸钾溶液褪色
B.1 mol顺式脂肪酸最多与2 mol氢气发生加成反应
C.能与乙醇发生酯化反应
D.能与溴发生加成且生成物相同
(4)顺式脂肪酸多为液态,空间呈弯曲状,反式脂肪酸多为固态,空间呈线型。油脂长时间高温加热,会产生反式脂肪酸,人类长期食用油炸食品,血液中反式脂肪酸过高容易堵塞血管而导致心脑血管疾病。这说明反式脂肪酸比顺式脂肪酸的硬度________(填“大”或“小”),熔点________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯化亚硝酰(NOCl)足一种红黄色气体,其熔点- 64.5℃,沸点-5.5℃,可被水分解,其一种制备原理为Cl2+2NO =2NOC1。实验装置如下图所示,回答下列问题:

(1)实验前须排尽装置I、Ⅱ、Ⅲ中的空气,其原因是__________________________。
(2)NO是用铜与稀硝酸反应制得,其离子方程式为__________________________。
(3)图中各装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
(4)装置I、Ⅱ的作用是观察气泡调节气体的流速和________________________________。
(5)装置V是为了吸收尾气,防止污染环境,其中吸收NOC1时反应的化学方程式为____________(非氧化还原反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于醇化学性质的说法正确的是( )
A.乙醇分子中的氢原子均可被金属钠取代
B.乙醇在浓硫酸作催化剂时加热至 140 ℃可以制备乙烯
C.交警检查司机酒后驾车是利用了乙醇能被重铬酸钾氧化的性质
D.所有的醇都可以被氧化为醛或酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸铁铵[(NH4)3Fe( C6 H5O7)2,摩尔质量488 g/mol] 是一种重要的食品添加剂。一种制备柠檬酸铁铵的实验步骤如下:

步骤1.在右图三颈烧瓶中加入16.7 g FeSO4·7H2O、40 ml.蒸馏水,3mL硫酸和1 g NaClO3,强力搅拌;
步骤2.升温至80℃,再补加l g NaClO3;
步骤3.向反应器中加入NaOH溶液,温度控制在80~90℃,剧烈搅拌;
步骤4.过滤,洗涤,沥干,得活性Fe(OH)3;
步骤5.将Fe(OH)3和一定量的水加入三颈烧瓶中,控制95℃以上,加入计算量的柠檬酸溶液,搅拌,并保温1h;
步骤6.冷却到50℃,搅拌下加入氨水40 mL,静置、浓缩至膏状,80℃干燥得柠檬酸铁铵24.9 g。
回答下列问题:
(1)步骤1发生反应的离子方程式为_____________________________。
(2)步骤2再补加NaClO3的目的是_____________________________。
(3)步骤3确定Fe3+已沉淀完全的方法是_____________________________。
(4)步骤4过滤时,所需硅酸盐质仪器除烧杯外,还需要_____________________________;证明Fe(OH)3已被洗涤干净的方法为__________________________。
(5)柠檬酸铁铵的产率为_________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式CO32﹣+2H+═H2O+CO2↑中CO32﹣的代表的物质可以是( )
A.CaCO3
B.NaHCO3
C.Na2CO3
D.BaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com