
| A. | CH3-CH=CH-CHO | B. | CH3-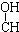 - -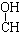 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-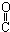 -CH2-CHO -CH2-CHO |
分析 含-OH、-COOH可发生酯化反应,含碳碳双键、-CHO可发生还原反应、加成反应,含-OH且与-OH相连C的邻位C上有H可发生消去反应,以此来解答.
解答 解:A.含碳碳双键、-CHO可发生还原反应、加成反应,不能发生酯化、消去反应,故A不选;
B.含-OH可发生酯化、消去反应,不能发生还原、加成反应,故B不选;
C.含-OH可发生酯化、消去反应,含-CHO可发生还原、加成反应,含有碳碳双键,可发生加成反应,故C选;
D.含-CHO可发生还原反应、加成反应,含-OH可发生酯化反应,但不能发生消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、醛、烯烃性质的考查,选项D为解答的易错点,注意醇消去反应的结构特点,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E、C、D、B、A | B. | B、A、E、D、C | C. | E、B、A、D、C | D. | A、B、C、D、E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①②③④ | C. | ④②①③ | D. | ③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中的阳离子为Fe2+、Fe3、H+ | B. | 样品中金属Fe的质量为4.48g | ||
| C. | 样品中CuO的质量为4.0 | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com