
 .
. 分析 主族元素A、B、C、D的原子序数都小于18,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为C元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为O元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为H元素;氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O;水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素,以此来解答.
解答 解:主族元素A、B、C、D的原子序数都小于18,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为碳元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为氧元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为氢元素,氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O,水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素.
(1)由上述分析可知,A为H,B为O,C为C,D为Na,故答案为:H;O;C;Na;
(2)H、O、C、Na四种元素可以形成化合物碳酸氢钠,其化学式为NaHCO3,故答案为:NaHCO3;
(3)B、D在加热条件下形成化合物为Na2O2,其电子式为  ,故答案为:
,故答案为: .
.
点评 本题考查结构性质位置关系,为高频考点,把握原子的电子排布、元素化合物性质推断元素为解答的关键,侧重分析与推断能力及常见化学用语的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 空硬质玻璃管 | 硬质玻璃管+氧化铜 | 硬质玻璃管+铜 | |
| 质量(g) | w | m | n |
| A. | $\frac{16m}{m-n}$ | B. | $\frac{16(w-n)}{m-n}$ | C. | $\frac{16n}{m-n}$ | D. | $\frac{16(n-w)}{m-n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.
根据组成原电池的条件,设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
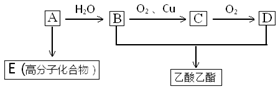 已知:
已知: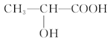 乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:
乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示: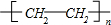 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 3:5 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着化学科学的发展和提高,自然界的一切都将以人的意志为转移 | |
| B. | 生物固氮是指植物通过叶面直接吸收空气的氮气 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 绿色食品是不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
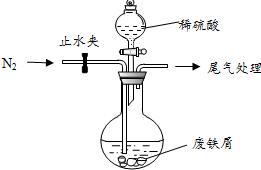 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com