
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显中性 |
| C、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-12 |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 .下列各物质中,能形成类似上述两种空间异构体的是( )
.下列各物质中,能形成类似上述两种空间异构体的是( )| A、1,1-二氯乙烯 |
| B、2-甲基-2-戊烯 |
| C、3-甲基-2-戊烯 |
| D、1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某期刊封面上有如下一个常见分子的球棍模型图图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图代表的有机物中含有的官能团是( )
某期刊封面上有如下一个常见分子的球棍模型图图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,该模型图代表的有机物中含有的官能团是( )| A、氨基和羧基 |
| B、碳碳双键和羧基 |
| C、碳碳双键和羟基 |
| D、氨基和醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.75倍 | B、11.5倍 |
| C、30.67倍 | D、46倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从碘水中提取单质碘,不能用无水乙醇代替CCl4 |
| B、MgCl2溶液混有少量FeCl3,加足量Mg(OH)2调pH后过滤 |
| C、用广泛pH试纸测得0.10mol?L-1 NH4Cl溶液的pH=5.2 |
| D、CO2混有少量SO2,除杂试剂和方法为:酸性KMnO4溶液、浓硫酸,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的反应过程与能量关系可以用图表示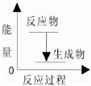 |
| B、若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C、若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D、若将该反应设计成原电池,负极发生的反应是:Fe-2e=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间变化 |
| B、AB的生成速率与消耗速率相等 |
| C、A2、B2的浓度和AB的浓度相等 |
| D、A2、B2、AB的分子数之比为1:1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com