
【题目】某高聚物的结构简式如下:
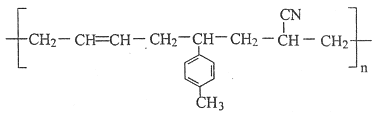
则形成该高分子化合物的单体的结构简式分别为________。
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有( )
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.第二周期主族元素的原子半径随核电荷数增大依次减小
C.卤素氢化物中,![]() 的沸点最低的原因是其分子间的范德华力最小
的沸点最低的原因是其分子间的范德华力最小
D.价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究高效催化剂是解决汽车尾气中的 NO 和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
则汽车尾气的催化转化反应 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃时,在分别装有催化剂 A 和 B 的两个容积为 2 L 的刚性密闭容器中,各充入物质的量均为nmol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如下表:
时间/min | 0 | 10 | 20 | 30 | ∞ |
A容器内压强/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器内压强/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判断催化剂 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡转化率为 __________。400℃时,用压强表示的平衡常数Kp__________(kPa)-1 (保留两位小数)。
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是 __________。
(3)为研究气缸中NO的生成, 在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应 N2(g)+ O2(g)2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是_________(填序号)。
A.2v正(O2)= v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=l D.容器内温度不变
②为减小平衡混合气中 NO 的体积分数, 可采取的措施是 ___________。
(4)对于缸中NO的生成,化学家提出了如下反应历程:
第一步 O22O 慢反应
第二步 O+N2NO+N 较快平衡
第三步 N+O2NO+O 快速平衡
下列说法错误的是_______(填标号)。
A.第一步反应不从N2分解开始,是因为N2比O2稳定
B.N、O 原子均为该反应的催化剂
C.三步反应中第一步反应活化能最大
D.三步反应的速率都随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H3AsO4水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系。下列说法错误的是( )
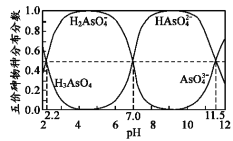
A.NaH2AsO4溶液呈酸性
B.向NaH2AsO4溶液滴加NaOH溶液过程中,c(H2AsO4-)/c(HAsO42-)先增加后减少
C.H3AsO4和HAsO42-在溶液中不能大量共存
D.Ka3(H3AsO4)的数量级为10-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸加热制取乙烯,实验装置如图,制备过程中,常会看到烧瓶中液体变黑,并有刺激性气味气体(SO2)产生。
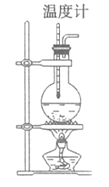
(1)制备乙烯的化学方程式_________。
(2)加热至140℃时发生副反应,写出该反应有机产物的结构简式__________,该反应的反应类型为:__________。
(3)写出产生SO2的化学方程式:___________。
(4)图中一处明显的错误是__________,加入碎瓷片的作用是__________。
(5)有人设计下列实验以确认上述混合气体中有乙烯和SO2。装置①、②、③、④可盛放的试剂是①__________;②__________;③品红;④__________。(填字母)

A. 品红溶液 B. NaOH溶液 C. 浓H2SO4 D. 酸性KMnO4溶液
(6)实验(5)中确认含有乙烯的现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及化学学科观点的有关说法正确的是![]()
A. 微粒观:二氧化硫是由硫原子和氧原子构成的
B. 转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和
C. 守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g
D. 结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液.根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( )

A.2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
B.负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O
C.测量原理示意图中,电流方向从Cu→Ag2O
D.电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究 MnO2与FeCl3·6H2O反应产物。

(查阅资料)FeCl3是一种共价化合物,熔点306℃,沸点315℃。
实验编号 | 操作 | 现象 |
实验 1 | 按上图所示,加热A中MnO2与FeCl3·6H2O混合物 | ①试管A中固体部分变液态,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中KI-淀粉溶液变蓝 |
实验 2 | 把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热。 | A中固体部分变液态,产生白雾和黄色气体,B中KSCN溶液变红 |
(实验探究)实验操作和现象如下表:
(问题讨论)
(1)实验前首先要进行的操作是______________________________。
(2)实验1和实验2产生的白雾是_______(填化学式)溶解在水中形成的小液滴。
(3)请用离子方程式解释实验2中黄色气体使KI-淀粉溶液变蓝色的原因_____________。
(4)为确认黄色气体中含有Cl2,学习小组将实验1中试管B内KI-淀粉溶液替换为NaBr溶液,发现B中溶液呈橙色,经检验无Fe2+,说明黄色气体中含有Cl2。用铁氰化钾溶液检验Fe2+的离子方程式是_________________________________。选择NaBr溶液的原因是________________________________________________________________。
(实验结论)
(5)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1:2,则A中发生反应的化学方程式为____________________________________________________。
(实验反思)
该学习小组认为实验1中溶液变蓝,也可能是酸性条件下,I-被空气氧化所致,可以先将装置中的空气排尽,以排除O2的干扰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com