
分析 (1)1mol任何物质中所含有的粒子数为阿伏伽德罗常数个,约为6.02×1023个;
(2)根据国际规定1mol任何微粒的集合体含有的微粒数来回答;
(3)氢气是由2个氢原子构成的分子;
(4)根据m=nM结合硫酸的分子构成来回答.
解答 解:(1)1mol任何物质中所含有的粒子数为阿伏伽德罗常数个,约为6.02×1023个,故答案为:6.02×1023;
(2)国际规定1mol任何微粒的集合体含有的微粒数和0.012kg12C中约含有的碳原子数目相等,故答案为:0.012;
(3)在0.1molH2中,含有0.2molH,故答案为:0.2;
(4)1.5molH2SO4的质量是1.5mol×98g/mol=147g,其中O原子物质的量是硫酸分子的4倍,即为6mol,H原子物质的量是硫酸物质的量的2倍,即3mol,
故答案为:147g;6;3.
点评 本题考查学生物质的量的概念以及有关物质的量和阿伏伽德罗常数的计算知识,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
 (4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O | |
| B. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O | |
| C. | 向1mol明矾的水溶液当中加入氢氧化钡,当沉淀的质量最大时离子方程式科表示为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 酸性高锰酸钾和过氧化氢制取少量氧气:4MnO4-+4H2O2+12H+=4Mn 2++7O2↓+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
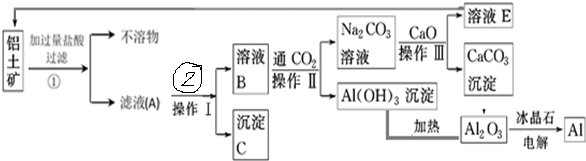
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com