
(16分)X、Y、Z、W四种常见元素,且均为短周期元素。
已知:①X的最高价氧化物对应的水化物为无机酸中最强酸
②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料
③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料
④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(2)Z的氧化物在通讯领域用来作 ,工业上制Z单质的化学反应方程式为 。
(3)在50mL ,lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为 mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列三种不同的实验方案进行探究。填写下列空白:
[探究一]
实验方案:Y、W合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称取一定质量的Y、W合金粉末样品,加入过量的Na0H溶液,充分反应。实验中发生反应的化学方程式是 。
②过滤、洗涤、干燥、称量剩余固体。若未洗涤固体,将导致测得的W的质量分数
(填“偏高”或“偏低”)。
[探究二]
实验方案:称量xg Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:
③欲计算W的质量分数。该实验中还需测定的数据是 。
④若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
(1)6H++Al2O3=2Al3++3H2O(2分)
(2)光导纤维(2分) SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
(3)360 (2分)
(4)①2Al+2NaOH+2H2O=2NaAlO2+H2 ↑(2分);②偏高(2分)
③充分灼烧,冷却后粉末的质量(2分);④是(2分)。
【解析】
试题分析:X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl元素;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,则Y为Al元素;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,则Z为Si元素;W被称为军事金属,可在CO2中燃烧,则W为Mg元素。
(1)X的最高价氧化物对应水化物为HClO4,Y的氧化物为Al2O3,则离子方程式为6H++Al2O3=2Al3++3H2O。
(2)Z的氧化物为SiO2,在通讯领域用来作光导纤维;工业上用C还原SiO2制取单质Si,则化学方程式为:SiO2+2C Si+2CO↑。
Si+2CO↑。
(3)得到1.56g沉淀为Al(OH)3,物质的量为:1.56g÷78g/mol=0.02mol,AlCl3物质的量为:0.05L×1mol?L?1=0.05mol,发生的反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH= NaAlO2+2H2O,0.05mol AlCl3完全反应需要NaOH为0.15mol,生成0.05mol Al(OH)3,则溶解的NaOH为0.05mol—0.02mol=0.03mol,则溶解Al(OH)3消耗的NaOH为0.03mol,共消耗NaOH为0.15mol+0.03mol=0.18mol,则加入NaOH溶液的体积最多为:0.18mol÷0.5mol?L?1=0.36L=360mL。
(4)①Al与NaOH、H2O反应生成NaAlO2和H2 ,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+H2 ↑。
②若未洗涤固体,金属Mg表面粘附杂质,则称量金属Mg的质量分数偏高。
③欲计算W的质量分数,还需要知道灼烧后生成的Al2O3和MgO的质量,所以该实验中还需测定的数据是:充分灼烧,冷却后粉末的质量
④若用空气代替O2进行实验,空气中的CO2能与Mg反应生成C和MgO,使固体的质量增大,产生误差,所以若用空气代替O2进行实验,对测定结果产生影响。
考点:本题考查元素的推断、实验方案的分析与设计、方程式的书写、化学计算。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:推断题
(12分)甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:实验题
(13分) 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是___________ ______________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。 于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
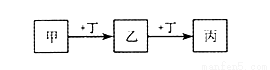
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Cl2,则丁可能是Fe
C.若丁是CO2,则甲可能为Mg
D.若丁是HCl,则甲一定是Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21 mol B.0.25 mol C.0.3 mol D.0.35 mol
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
不需要化学方法就能从人类的重要资源——海水中获得的物质是
A.食盐、淡水 B.钠、镁 C.氯气、烧碱 D.溴、碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com