
【题目】下列关于试剂存放的叙述正确的是( )

A. 浓硫酸的装运包装箱应贴上如图所示的标志
B. 金属钠保存在CCl4中(钠的密度小于CCl4)
C. 氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
D. 硝酸银溶液存放在无色试剂瓶中
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物vL(标准状况),溶于mg水中,得到质量分数为w的溶液,物质的量浓度为cmol.L-1,密度为ρg.cm-3,则下列说法不正确的是
A.相对分子质量M= ![]() B.物质的量浓度c=
B.物质的量浓度c= ![]()
C.质量分数w= ![]() D.溶液密度
D.溶液密度![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]
工业炼铜的方法有由黄铜矿(主要成分是CuFeS2,杂质不含铜元素)炼制精铜的工艺流程示意图如图:

(1).黄铜矿中铜的质量分数为0.4,生产1吨纯铜理论上需要这种黄铜矿____________吨。
(2).在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,_____________________。且部分Fe的硫化物转变为Fe的低价氧化物。
(3).从环保环境和充分利于原料角度看如何处理和利用产生的烟气?___________。
(4).在转炉中,冰铜中的Cu2S先被氧化成Cu2O,,生成的Cu2O再与Cu2S反应,两步反应的热化学方程式为:①2Cu2S(s)+3O2(g)═2Cu2O(s))+2SO2(g)△H=-768.2kJ.mol-1
②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ.mol-1
则反应Cu2S转化为铜的热化学方程式:_________________________。
将3molCu2S与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全且Cu2S完全参与反应),得到单质铜3mol,所得气体中SO2的体积分数为_____________。
(5).电解精炼铜,电解质溶液为______________,电解一段时间后,电解质溶液的浓度_____________(填“减少”、“不变”、或“增大”)
(6).利于反应Cu+H2O2+H2SO4=CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
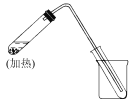
(1)左边大试管中要加入几片碎瓷片,其作用是_________________;
(2)该装置中使用的玻璃导管较长,其作用是__________________;
(3)烧杯中还要盛有的物质是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识正确的是( )
A.油脂在空气中完全燃烧生成H2O和CO2
B.淀粉和纤维素互为同分异构体
C.金属钠可区分乙醇和乙酸
D.苯与饱和溴水混合,发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. NH3易液化,液氨常用作制冷剂
B. 稀HNO3氧化能力弱于浓HNO3
C. 贮存铵态氮肥时要密封保存,并放在阴凉处
D. 硝酸只能被ZnFe等金属还原成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。(忽略氧气对反应的影响)
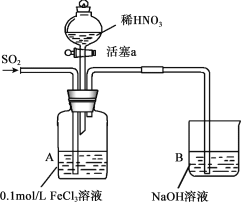
实验记录如下:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体。 | A中黄色溶液迅速变成深红棕色,最终变为浅绿色。 |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液。 | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀。 |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色。 |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气。 | 溶液变为红色;液面上方有少量红棕色气体生成。 |
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述): 。
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为: Fe3+ + 6SO2 ![]() Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
Fe(SO2)63+。请用化学平衡移动原理解释实验I中溶液颜色变化的原因 。
(3)实验II中发生反应的离子方程式是 。
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示) 。
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是 。
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 常温下,l L 0.l mol·L-1NH4NO3溶液中含有的NH4+ 数是0.l NA
C. 常温常压下,22.4 L SO2和O2混合气体中含有的氧原子数是2 NA
D. 铁铝混合物与一定量盐酸反应生成1 mol H2时,转移电子数是2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com