
【题目】对下列图象的描述正确的是( )

①根据图甲可判断反应的△H<0
②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
③图丙可表示压强(p)对反应2A(g)+2 B(g)3 C(g)+ D(s)的影响
④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的愔况.
A. ①③ B. ②④ C. ③④ D. ①②
【答案】B
【解析】试题分析:①根据图①可知,交点之前,反应未达平衡,交点时处于平衡状态,交点后增大温度正反应速率增大比逆反应速率增大更多,平衡向正反应移动,升高温度平衡向吸热反应移动,故可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)正反应是吸热反应,故①错误;②由图可知,Fe3+在pH=3左右沉淀完全,此时铜离子不沉淀,pH=5时Cu2+开始沉淀,故可以加入适量CuCO,调节pH值至3~5,使铁离子转变成氢氧化铁沉淀,除去CuSO4溶液中的Fe3+,不引入杂质,故②正确;③由图③可知,p2到达平衡时间短,说明压强p2>p1,平衡时反应物的转化率不变,反应前后气体的体积不变,对可逆反应2A(g)+2B(g)
2AB3(g)正反应是吸热反应,故①错误;②由图可知,Fe3+在pH=3左右沉淀完全,此时铜离子不沉淀,pH=5时Cu2+开始沉淀,故可以加入适量CuCO,调节pH值至3~5,使铁离子转变成氢氧化铁沉淀,除去CuSO4溶液中的Fe3+,不引入杂质,故②正确;③由图③可知,p2到达平衡时间短,说明压强p2>p1,平衡时反应物的转化率不变,反应前后气体的体积不变,对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s),正反应是体积减小的反应,故图象p2应表示使用催化剂,故③错误;④醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故④正确;故选B。
3C(g)+D(s),正反应是体积减小的反应,故图象p2应表示使用催化剂,故③错误;④醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故④正确;故选B。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成A2D和A2D2,A2D是最常见的溶剂;E原子次外层电子电子数等于其它层电子数之和。则
(1)E在周期表中的位置是______________,B、C、D、E与A形成的化合物中稳定性最强的是_______(该化学式)。
(2)C、D、E的离子半径由大至小顺序______________。
(3)写出B与由A、C、D组成的化合物的浓溶液在加热条件下的反应方程式:_________。
(4)A-E五种元素中,含同一元素的各类物质能实现下列转化的有______(填元素符号)。
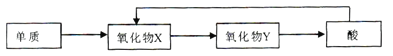
(5)A2D2与FeSO4溶于稀硫酸,反应的离子方程式为_________。
(6)由A、B、C、D四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为(名称)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)可用于杀菌消毒,下列有关臭氧的说法正确的是
A. 臭氧的摩尔质量为48 B. 臭氧分子由氧气分子构成
C. 臭氧与氧气互为同分异构体 D. 1个臭氧分子由3个氧原子构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+):n(Cl-)可能为7:3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4[Ksp(CaSO4)=9×10-6] 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)·c(SO42-)均相等
B.d点溶液通过蒸发可以变到c点
C.b点对应的Ksp大于a点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定小于3×10-3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.能生成碱的金属元素都在ⅠA族
B.稀有气体元素原子的最外层电子数均为8
C.第二周期ⅣA族元素的原子核电荷数和种子数一定为6
D.原子序数为14的元素位于元素周期表的第3周期ⅣA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com