
| | 已知 | 类推 |
| A | 将Fe加 入到CuSO4溶液中 入到CuSO4溶液中Fe + Cu2+ =" Cu" + Fe2+ | 将Na加入到CuSO4溶液中 2Na + Cu2+ =" Cu" + 2Na+ |
| B | 氢氧燃料电池的负极反应(稀硫酸作电解质溶液):H2 – 2e— = 2H+ | 氢氧燃料电池的负极反应(氢氧化钾溶液作电解质溶液):H2 – 2e— + 2OH—=2H2O |
| C | 用惰性电极电解CuSO4溶液 2Cu2++ 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu | 用惰性电极电解CuCl2溶液 2Cu2+ + 2H2O  4H+ + O2↑+ 2Cu 4H+ + O2↑+ 2Cu |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+ 2H+ = Ca2+ + H2O + CO2↑ | 将少量CaCO3粉末投入足量醋酸溶液中 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
科目:高中化学 来源:不详 题型:实验题
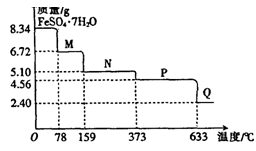
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.896L | B.1.12L | C.1.68L | D.2. 24L 24L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.m1一定大于m2 | B.m1可能大于m2 |
| C.m1可能等于m2 | D.m1一定等于m2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)
量浓度以及产生氢气的体积。(注:氢气的体积测定环境为标准状况)查看答案和解析>>
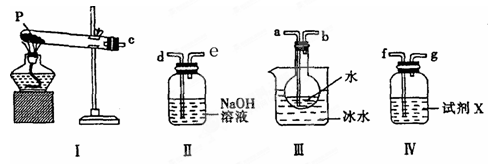
科目:高中化学 来源:不详 题型:实验题
| A.50 mL烧杯 | B.50 mL量筒 | C.100 mL量筒 | D.25 mL滴定管 |
 生的离子反应方程式
生的离子反应方程式 ________________________,加入氨水要过量的原因是___________________________。
________________________,加入氨水要过量的原因是___________________________。 _
_ _________________
_________________ _______________________________________________。
_______________________________________________。 量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________查看答案和解析>>
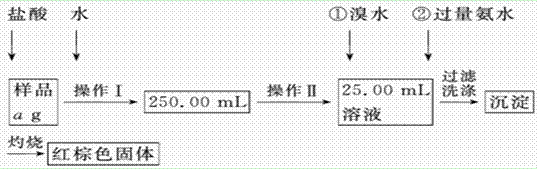
科目:高中化学 来源:不详 题型:实验题
 (只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n] 和Fe2O3。工艺流程如下:
(只含Fe2O3、FeO、SiO2、Al2O3)可制备新型净水剂碱式氯化铝[Al2(OH)nCl6-n] 和Fe2O3。工艺流程如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
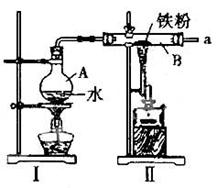
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com