
S(单斜)和S(正交)是硫的两种同素异形体。
已知:
S(单斜,s)+O2(g) ==SO2(g) △H1=-297.16 kJ·mol-1
S(正交,s)+O2(g) ==SO2(g) △H2=-296.83 kJ·mol-1
S(单斜,s) == S(正交,s) △H3
下列说法正确的是
A.△H3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)===S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) △H3>0,单斜硫比正交硫稳定
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:___________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2=S4O
+I2=S4O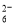 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是______________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是____________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:填空题
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) CH3OH(g) 方法二 CO2(g)+3H2(g)
CH3OH(g) 方法二 CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式 。
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H=―393.5kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H=―566kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+141kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―235.8kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学试卷(解析版) 题型:选择题
已知:2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1 ,CH4(g) + 2O2(g)= CO2(g) + 2H2O(l) △H = -890 kJ·mol-1 ,现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是
A.1:1 B.1:3 C.1:4 D.2:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:实验题
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。反应原理:


实验步骤:
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器 a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第二次月考化学卷(解析版) 题型:选择题
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )


查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷(解析版) 题型:选择题
VmLAl2(SO4)3 溶液中含Al3+ag,取V/4mL溶液稀释到4VmL,则稀释后溶液中SO42-的物质的量浓度是 ( )
A.125a/36V mol/L B.125a/18Vmol/L
C.125a/9V mol/L D.125a/54V mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com