

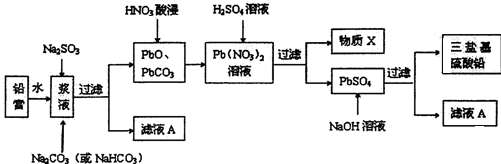
分析 (1)碱性锌锰电池负极发生氧化反应,Zn在负极放电生成Zn(OH)2;酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成;
(2)由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;随pH值的升高汞的去除率先降低后增加;
(3)废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+.加入试剂A除Hg,以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液吸收,由制备锌锰铁氧体(MnxZn1-xFe2O4)可知试剂A为Fe,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分;
(4)氢氧化钠可以溶解氢氧化锌,碳酸氢钠溶液pH值小于10.5且可以得到一些碳酸盐沉淀;
(5)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式.
解答 解:(1)碱性锌锰电池负极发生氧化反应,Zn在负极放电生成Zn(OH)2,电极反应式为:Zn-2e-+2OH-=Zn(OH)2,酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成,反应方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案为:Zn-2e-+2OH-=Zn(OH)2;MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;由图象可知,汞的吸收率随着PH的增大先降低后增加,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;随pH的升高汞的吸收率先降低后增加;
(3)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合加热后获得锰锌铁氧化体组成,
故答案为:调节溶液中Fe、Mn元素的成分,符合加热后获得锰锌铁氧化体组成;
(4)氢氧化钠可以溶解氢氧化锌,碳酸氢钠溶液pH值小于10.5且可以得到一些碳酸盐沉淀,使用氨水调节pH最好,故选:①;
(5)Mn为+2价、Zn为+2价,根据化合价代数和为0,可知Fe元素化合价为+3,当x=0.2时,该物质的化学式可表示为Mn0.2Zn0.8Fe2O4,即Mn、Zn、Fe的原子个数之比=1:4:10,所以用氧化物形式可表示为:MnO•4ZnO•5Fe2O3,
故答案为:MnO•4ZnO•5Fe2O3.
点评 本题考查化学工艺流程、物质的分离提纯、对操作的分析评价、氧化还原反应的有关应用、图象分析等,侧重考查学生对知识的迁移运用,并不需要明确每一步骤的目的,结合题目问题进行解答,物质组成的计算、分离提纯以及反应条件的控制等化学工艺流程题是高考的靓点,化学工艺流程是“无机框图题”的变革与创新.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: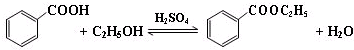
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com