
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(![]() )由大到小的顺序是______________。
)由大到小的顺序是______________。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
解析:(1)分析思路涉及两个方面,若是碱的溶液,则抑制水的电离,使水的电离程度减小,水电离的c(OH-)为10-12 mol·L-1;若是强碱弱酸盐的溶液,因水解时水的电离起促进作用,水电离c(OH-)为10-2 mol·L-1。
(2)溶液的体积相等,不考虑其他,溶液中各阳离子的物质的量相同,因Cu2++2H2O![]() Cu(OH)2+2H+,即使有少量Cu2+水解,但因1 mol Cu2+水解可生成2 molH+,故CuSO4溶液中阳离子的总的物质的量最大。
Cu(OH)2+2H+,即使有少量Cu2+水解,但因1 mol Cu2+水解可生成2 molH+,故CuSO4溶液中阳离子的总的物质的量最大。
(3)由于弱电解质的电离和盐类的水解程度都是比较小的,故③中NH3·H2O提供的c(![]() )最小,②中电离出的H+抑制
)最小,②中电离出的H+抑制![]() 水解,④中CH3COO-的水解促进
水解,④中CH3COO-的水解促进![]() 的水解。
的水解。
答案:(1)10-12 mol·L-1或10-2 mol·L-1
(2)①
(3)②>①>④>③


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:山东省济宁市金乡一中2011-2012学年高二12月月考化学试题 题型:022
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为________.
(2)等体积的下列溶液中,阳离子的总物质的量最大的是________.
①0.2 mol·L-1
的CuSO4溶液②0.1 mol·L-1
的Na2CO3③0.2 mol·L-1
的KCl④0.1 mol·L-1
的Na2SO4(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是________(填序号).
①NH4Cl
②NH4HSO4
③NH3·H2O
④CH3COONH4
(4)
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A①则Na2A
溶液显________(填“酸性”“中性”或“碱性”),理由是________(用离子方程式表示).②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是:________(填序号).
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
查看答案和解析>>
科目:高中化学 来源:江苏省上冈高级中学2011-2012学年高二下学期期中考试化学试题 题型:022
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为________mol·L-1.
(2)等体积的下列溶液中,阳离子的总物质的量最大的是________.(填序号).
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺________.(填序号).
①NH4Cl
②NH4HSO4
③NH3·H2O
④CH3COONH4
(4)水的电离平衡如图所示:
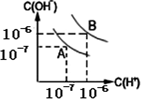
①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点.则此时水的离子积从________增加到________.
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com