
ij��ѧ��ȤС����һ��ʵ��̽���з��֣��������Һ����μ�����������Һʱ����Һ��ɫ������죬����Ӧ������С���С���ԱΪ�ˡ��쳣������չ�����ۣ����������������������ԭ�������֣���Ϊ�����ʵ�����̽����֤��
����˷�Ӧ���̷��ȣ��¶����ߣ���Ӧ���ʼӿ죻
���������
��ʵ��Ŀ�ġ�̽�������������ط�Ӧ�����ʱ仯���쳣��ԭ��
��ʵ����Ʒ���������Թܡ���ͷ�ιܡ���Ͳ��ҩ�ס��������ȣ�
�Լ���0.1mol/L H2C2O4��Һ��0.05mol/L KMnO4�������ữ����Һ�ȡ�
������ݸ���ȤС���ʵ��̽�����˼·������������ȱ���ݡ�
��1�����ᣨH2C2O4�����ᣩ������KMnO4��Һ��Ӧ�����ӷ���ʽΪ����֪��MnO4����ԭ������Mn2+�� ��
��2��Ҫ��ɶԲ�����ʵ����֤�����ٻ���Ҫһ��ʵ�������� ��
��3������������______________________________________________________________��Ҫ���ʵ����֤������и�ʵ�黹Ҫ����һ���Լ���һ���������ֱ��� ��
��4�����ڲ�����������Ʒ�������ʵ�飬���������ʵ���¼�����ݡ�
| | �Թ�A | �Թ�B |
| �����Լ� | | |
| ��Ԥ�ڣ�ʵ������ ����ɫʱ�䣩 | | |
| ���� | �������ȷ | |
��1��5H2C2O4+ 2MnO4��+6H+=10CO2��+2 Mn2++8H2O����2�֣�
��2���¶ȼơ���1�֣�
��3�����ɵ�Mn2+�ڷ�Ӧ�����������ã��ӿ��˷�Ӧ���ʣ�2�֣���MnSO4(S)�������2�֣�
��4����4�֣� �Թ�A �Թ�B �����Լ� 1mL0.05mol/L KMnO4
2mL0.1mol/L H2C2O41mL0.05mol/L KMnO4
2mL0.1mol/L H2C2O4
����MnSO4��Ԥ�ڣ�ʵ������
����ɫʱ�䣩��ɫ���� ��ɫ�ܿ� ���� �������ȷ
���������������1��������л�ԭ�ԣ������Ը����������Ϊ������̼��������ʾMnO4����ԭ������Mn2+ �����Ը�������ԭ��Ӧ�ķ���ʽΪ��5H2C2O4+ 2MnO4��+6H+=10CO2��+2 Mn2++8H2O��
��2����ʵ��Ŀ�ij�����̽�������������ط�Ӧ�����ʱ仯��һ����������ŷ�Ӧ�Ľ��У���Ӧ���Ũ���½���Ӧ����Ҳ��֮��С������ȴ�����쳣�����Դ�Ӱ�컯ѧ��Ӧ���ʵĵ������������⣬���ݲ���1���ѵó����ͻ���ԭ�����¶ȣ�������Ҫ�ⶨ�¶ȱ仯�������¶ȼƣ��ʴ����¶ȼơ�
��3�����˲���1���ܼӿ췴Ӧ���ʵ����ػ��д��������Բ�������ԴӴ������֣���˿��Եó����룺���ɵ�Mn2+�ڷ�Ӧ�����������ã��ӿ��˷�Ӧ���ʡ���Ҫ��֤��һ���룬���Լ��뺬��Mn2+���Լ��������������̣�ͬʱ����������ⶨ��Ӧ�����Ƿ��ܵ�Ӱ�죬�Դ�����֤��һ�����Ƿ���ȷ��
��4�����ڲ���������ʵ����֤��Ҫ���Ա�ʵ�飬���ڷ�Ӧ���ֵĸ������Ϊ��ɫ�Լ������Կ��Դ���ɫ�仯�����ϳ����жϲ��������ȷ�ԣ�����ʵ�鲽�����£� �Թ�A �Թ�B �����Լ� 1mL0.05mol/L KMnO4
2mL0.1mol/L H2C2O41mL0.05mol/L KMnO4
2mL0.1mol/L H2C2O4
����MnSO4��Ԥ�ڣ�ʵ������
����ɫʱ�䣩��ɫ���� ��ɫ�ܿ� ���� �������ȷ
���㣺���⿼�����������ԭ��Ӧ����ʽ����ƽ��ʵ��̽����֪ʶ��


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��11�֣���һ���¶��£�10L�ܱ������м���5.0molSO2��4.5molO2����10min��Ӧ��ƽ��ʱO2��Ũ��Ϊ0.30mol/L������㣨д��������̣���
��1��10min��SO2��ת���ʣ� ��2�������ڷ�Ӧǰ��ƽ��ʱ��ѹǿ֮��(���������) ��
��3��ƽ�ⳣ��K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
��1������β����CO��NO2������һ�������¿��Է�����Ӧ��
4CO(g)+2NO2(g) 4CO2(g)+N2(g)����H=��1200 kJ��mol��1
4CO2(g)+N2(g)����H=��1200 kJ��mol��1
�ٺ��º��������£�����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A�������ڻ��������ɫ���ٱ仯 B�������ڵ�ѹǿ���ֲ���
C��2v��(NO2)=v��(N2) D�������ڻ�������ܶȱ��ֲ���
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ�����淴Ӧ�����ƶ�����________(�����)��
A����ʱ�����CO2 B���ʵ������¶�
C����С�������ʹ��ϵѹǿ���� D��ѡ���Ч����
�۶��ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����________(�����)��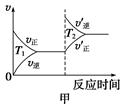
��2������β����CO��H2O(g)��һ�������¿��Է�����Ӧ��CO(g)+H2O(g) CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
| ��ʼ���ʵ��� | �� | �� | �� |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij̽��С���ý������ֱ���ϡ�����ϡ���ᷴӦ�ķ����о������벻ͬ�ᷴӦ�IJ��켰Ӱ�췴Ӧ�ٶȵ����ء�
ʵ��ҩƷ��2.0 mol/L���ᡢ4.0 mol/L���ᡢ2.0 mol/L���ᡢ4.0 mol/L���ᡢ��ͬ��С����Ƭ������(������������Ĥ���ѳ�ȥ)��ÿ��ʵ��������������Ϊ50.0 mL������������Ϊ9.0 g��
��.��ͬѧ����Ƭ�ֱ��ϡ���ᡢϡ���ᷴӦ��ʵ�鼰���������£�
| ��Ӧ���� (����) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L ���� | �������� | �϶����� | �������� | ��Ӧ���� | ��Ƭ�ľ� |
| 2.0 mol/L ���� | ���������� | ������ ���� | �������� | ||
| 4.0 mol/L ���� | ���������� | �������� | �бȽ����������� | ||
| ʵ��Ŀ�� | ʵ�� ��� | �¶� /�� | �������� ��̬ | ����Ũ�� /mol��L��1 |
| 1.ʵ��ٺ͢�̽������Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 2��ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 3��ʵ��ٺ͢�̽���������(��Ƭ�� ����)�Ը÷�Ӧ���ʵ�Ӱ�� | �� | 25 | ��Ƭ | 4.0 |
| �� | | | | |
| �� | | | | |
| �� | | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��14�� ÿ��2�֣�����ԭ�Ϻ췯��(�ظ�����:Na2Cr2O7��2H2O)��Ҫ���Ը�����(��Ҫ�ɷ�ΪFeO��Cr2O3,������Al2O3��SiO2������)Ϊ��Ҫԭ������,����Ҫ������������:
���������Ҫ��Ӧ�Ļ�ѧ����ʽ����:
4FeO��Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
��1�� ���з�Ӧ���ڻ�תҤ�н��е�,��Ӧʱ�費�Ͻ���,���������� ��
��2�� ����Al2O3�ڢ���ת���Ļ�ѧ��Ӧ����ʽΪ������ ����
��3�� �û�ѧƽ���ƶ�ԭ��˵��������е���������������������������������������������������(�����ӷ���ʽ�������˵��),������pH���Ͳ�����Ӱ����������������������
��4�� �����ữ��ʹCrO42-ת��ΪCr2O72-д���÷�Ӧ�����ӷ���ʽ:�� ��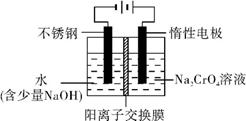
��5�� ��ҵ�ϻ����õ�ⷨ�Ʊ��ظ�����,��װ��ʾ��ͼ���ϡ�
�����ĵ缫��ӦʽΪ�� ;
�����ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�±���ϡ������ij������Ӧ��ʵ�����ݣ�
| ʵ�� ��� | ������ ��/g | ���� ״̬ | c(H2SO4)/ (mol��L��1) | V(H2SO4) /mL | ��Һ�¶�/�� | ������ʧ ��ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ˿ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | �� ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | ˿ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | �� ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | ˿ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | ˿ | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | ˿ | 1.1 | 50 | 30 | 44 | 40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
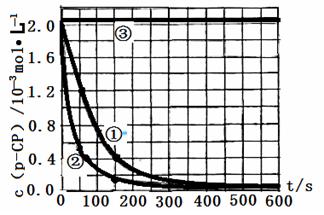
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�PH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����顣
��1�����������ʵ����Ʊ������в�Ҫ���ո�
| ʵ�� ��� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
| H2O2 | Fe2+ | ||||
| �� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | | | | |
| �� | | 298 | 10 | 6.0 | 0.30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ʵ(������)����˵��������������ʵ���
| A����������ҺpH>7 |
| B��������Һ���ܽ�̼��� |
| C��0��1mol��L-1������ҺpH=2��9 |
| D��pH=1�Ĵ�����Һϡ��100����pH<3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��£�����̼����MCO3(M��Mg2����Ca2����Mn2��)�ij����ܽ�ƽ����������ͼ��ʾ����֪: pM=" -lg" c(M)��pc(CO32��)= -lgc(CO32��)������˵����ȷ���� 
| A��MgCO3��CaCO3��MnCO3��Ksp�������� |
| B��a ��ɱ�ʾMnCO3�ı�����Һ����c(Mn2��)= c(CO32��) |
| C��b ��ɱ�ʾCaCO3�ı�����Һ����c(Ca2��)<c(CO32��) |
| D��c ��ɱ�ʾMgCO3�IJ�������Һ����c(Mg2��)��c(CO32��) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com