
����Ŀ���������ֳƻ����������������ԭ�ϣ�����Ҫ�ɷ�ΪFeS2.850�桫900��ʱ�������������������գ����ܷ������з�Ӧ����������е�N2��O2�����Ϊ4��1����3FeS2+8O2��Fe3O4+6SO2 ��4FeS2+11O2��2Fe2O3+8SO2
��1������35%����������Ʒ�����ʲ�������FeS2�ĺ���Ϊ ��
��2��ij���᳧ÿ���ú�FeS260%��������500t�������ᣬ����ڷ���¯����ʧ5%����SO2��ת����Ϊ90%��ÿ��������98%��������
��3�����������չ����п���������ͬʱ��������Ӧ������¯����SO2����Ҳ��ͬ����FeS2 72%���������ڿ��������ղ�����Ӧ����ȫ��Ӧ����ʽ����¯���е�SO2������������Ϊ���٣�
��4��Ϊȷ��SO2ת��ΪSO3��ת���ʣ�ij���᳧ʹ�ø��������������мӴ���������������¯����SO2��O2����������ֱ�ﵽ11%��9%��FeS2��ȫת��ΪFe2O3 �� ��ʽ���㸻�������е������������Ϊ���٣�
���𰸡�
��1��65.6%
��2��427.5t
��3���⣺��FeS2Ϊ1mol����3FeS2+8O2��Fe3O4+6SO2 ��֪����ȫ������Ҫ��n��O2��=1mol�� ![]() ������n��SO2��=2 mol����Ҫ�������ʵ���n��������=
������n��SO2��=2 mol����Ҫ�������ʵ���n��������= ![]() mol��0.2=
mol��0.2= ![]() mol����Ӧ¯�����ʵ���Ϊ2mol+
mol����Ӧ¯�����ʵ���Ϊ2mol+ ![]() mol��
mol�� ![]() =
= ![]() mol����¯����SO2������������SO2%=
mol����¯����SO2������������SO2%= ![]() ��100%=15.8%��
��100%=15.8%��
������¯����SO2���������Ϊ15.8%��
��4���⣺��¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol��11mol��9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2��֪����������Ϊ11mol�� ![]() ���ʸ��������е��������ʵ���Ϊ11mol��
���ʸ��������е��������ʵ���Ϊ11mol�� ![]() +9mol=
+9mol= ![]() �����������е��������������Ϊ��
�����������е��������������Ϊ�� 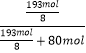 ��100%=23.2%��
��100%=23.2%��
�𣺸��������е������������Ϊ23.2%��
���������⣺��1������������Ԫ�غ���=FeS2�ĺ�����FeS2��SԪ��������������w��FeS2���� ![]() =35%�����w��FeS2��=65.6%���ʴ�Ϊ��65.6%����2����ɵ�98%��Ũ���������Ϊx���������غ�ã� 2H2SO4��FeS2
=35%�����w��FeS2��=65.6%���ʴ�Ϊ��65.6%����2����ɵ�98%��Ũ���������Ϊx���������غ�ã� 2H2SO4��FeS2
2��98t 120t
98%x 500t��60%����1��5%����90%![]()
��֮�ã�x=427.5t��
�ʴ�Ϊ��427.5t��
��1��FeS2������������FeS2��SԪ����������=��������Ʒ��SԪ��������������2������Ԫ���غ㣬�ɵù�ϵʽ��2H2SO4��FeS2 �� ��ÿһ���������ʡ���ʧ�ʶ�ת��ΪFeS2�������ʣ��ٽ�Ϲ�ϵʽ���㣻��3����FeS2Ϊ1 mol��������ȫ������Ҫ��n��O2�������ɵ�n��SO2������Ͽ���������������������������ʵ���������¯�������ʵ�������������SO2�����������4����¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol��11mol��9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2���������������ʵ����������Ǽ��㸻�������е��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������д�����ǣ���
A.��ȡ��ˮ�еĵⵥ��ʱ��Ӧѡ���л���ȡ��������ȡ����ˮ������
B.��������ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ����
C.��Һ����ʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
D.�������ʱ������ˮ����Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1���������м������ʣ��뽫����ĸ��Ҫ������ո��ڣ�
A��CH2=CH��COOH�����ᣨC17H33COOH��
B���Ҵ����Ҷ���
C�����ۺ���ά��
D�� ![]() ��
�� ![]()
E�� ![]() ��
�� ![]()
F�� ![]() ��
�� ![]()
�ٻ�Ϊͬϵ����� ��
�ڻ�Ϊͬ���칹����� ��
�ۼȲ���ͬϵ�Ҳ����ͬ���칹�壬���ɿ�����ͬһ�����ʵ��� ��
��2�������������ʣ��뽫����ĸ��Ҫ������ո��ڣ�
A������ B�������� C�������� D����֬
����I2�������� ��
����ŨHNO3�ʻ�ɫ���� ��
���ܷ���������Ӧ��ȡ�������� ��
�ܼ����������������Ƶ�������ͭ��Ӧ���ɺ�ɫ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��N2(g)��3H2(g) ![]() 2NH3(g) ��H����92.4 kJ��mol��1����ʼ��Ӧ��Ϊ N2 �� H2���ʵ���֮��Ϊ 1�U3���������ʵ������䣬�ڲ�ͬѹǿ���¶��£���Ӧ�ﵽƽ��ʱ ��ϵ�� NH3 �����ʵ����������±���
2NH3(g) ��H����92.4 kJ��mol��1����ʼ��Ӧ��Ϊ N2 �� H2���ʵ���֮��Ϊ 1�U3���������ʵ������䣬�ڲ�ͬѹǿ���¶��£���Ӧ�ﵽƽ��ʱ ��ϵ�� NH3 �����ʵ����������±���
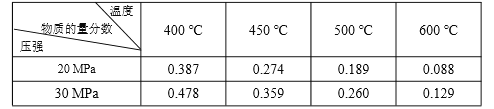
����˵����ȷ����
A. ��ϵ�� NH3 �����ʵ�������Խ��������Ӧ����Խ��
B. ��Ӧ�ﵽƽ��ʱ��N2 �� H2 ��ת����֮�Ⱦ�Ϊ 1
C. ��Ӧ�ﵽƽ��ʱ���ų���������Ϊ 92.4 kJ
D. 600 �棬30 MPa �·�Ӧ�ﵽƽ��ʱ������ NH3 �����ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۷�����PAR���Ƿ��������ϴ��б��������������ֹ������ϣ��ں��պ����������й㷺Ӧ�ã���ͼ�������������� ![]() �ϳɾ۷���E��·�ߣ�
�ϳɾ۷���E��·�ߣ� 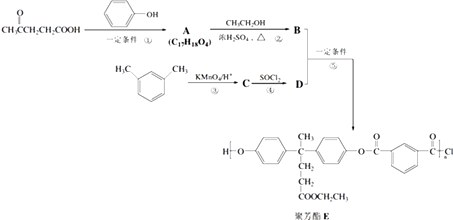
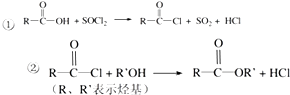
��֪��
��1�����������к��еĹ��������ʻ���������������ƣ���
��2��D�Ľṹ��ʽΪ ��
��3�����й����л���B��˵���������a���ܷ���ȡ����Ӧ b������Ũ��ˮ��Ӧc���ܷ�����ȥ��Ӧ d������H2�����ӳɷ�Ӧ
��4��A��B�Ļ�ѧ����ʽΪ ��
��5��C�ķ���ʽΪ �� F�Ƿ�������������C��ͬ���칹����ܷ���������Ӧ ������NaHCO3��Һ��Ӧ
�۷����������ֻ�ѧ������ͬ����ԭ�� �ܱ�����ֻ��2��ȡ�������� ![]() �ṹ
�ṹ
д��������һ��������NaOH��Һ���ȷ�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£� m g����A��n g����B�ķ�������ͬ������˵��������ȷ����
A. ����A������B����Է���������Ϊm��n
B. ͬ����������A��B�ķ��Ӹ�����Ϊn��m
C. ͬ��ͬѹ�£�A������B������ܶȱ�Ϊn��m
D. ͬ��ͬѹ�£�ͬ�����A������B�����������Ϊm��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A.ʹ��̪���ɫ����Һ�У�Na+��Al3+��SO ![]() ��Cl��
��Cl��
B.![]() =1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
=1��10��13mol?L��1����Һ�У�NH4+��Ca2+��Cl����NO3��
C.��Al��Ӧ�ܷų�H2����Һ�У�Fe2+��K+��NO ![]() ��SO
��SO ![]()
D.ˮ�����c��H+��=1��10��13mol?L��1����Һ�У�K+��Na+��AlO2����CO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.�����ж���˱��뱣����ˮ�У�ȡ��ʱҪ������
B.������ʳƷ��ʯ�͵ȹ�ҵ�����Ź㷺��Ӧ��
C.����һ����Ҫ��ҩ��Ԫ�أ�Ҳ����������ʳƷ�ı�ҪԪ��
D.��ҵ������������������Ӧ���Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧԭ��������������⣺
��1����֪��Si+2NaOH+H2O�TNa2SiO3+2H2 �� ijͬѧ���õ��ʹ����Ϊ�缫�������ԭ��أ�NaOHΪ�������Һ������ԭ��ظ����ĵ缫��ӦʽΪ��
��2����֪����C��s��+O2��g���TCO2��g����H=a kJmol��1����CO2��g��+C��s���T2CO��g����H=b kJmol��1����Si��s��+O2��g���TSiO2��s����H=c kJmol��1 �� ��ҵ�������ֹ���Ȼ�ѧ����ʽΪ��
��3����֪��CO��g��+H2O��g��H2��g��+CO2��g������Ϊ�÷�Ӧ�ڲ�ͬ�¶�ʱ��ƽ�ⳣ�����÷�Ӧ�ġ�H0���������������500��ʱ���и÷�Ӧ����CO��H2O��ʼŨ����ȣ�COƽ��ת����Ϊ ��
�¶ȡ� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com