
| A、水结成冰体积膨胀,密度变小 |
| B、水加热到很高的温度都难以分解 |
| C、CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D、HF、HCl、HBr、HI的热稳定性依次减弱 |


科目:高中化学 来源: 题型:
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
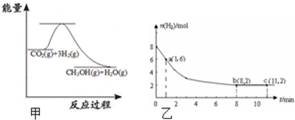 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(KNO3)=1.0mol/L的溶液中:Fe2+、Cl-、H+、Na+ | ||
| B、常温下,由水电离出的c(H+)=10-14mol/L溶液中:NH4+、CO32-、CH3COO-、SO42- | ||
| C、加入铝能产生大量氢气的溶液中:CH3CHO、MnO4-、K+、C6H5O- | ||
D、常温下,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y元素位于第二周期第ⅦA族或0族 |
| B、X、Y、Z三种元素中非金属性最强的是X元素 |
| C、X、Y、Z三种元素形成的简单离子的半径都比Mg2+半径小 |
| D、Z分别与X、Y形成的化合物都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
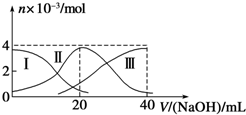 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 |
| C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
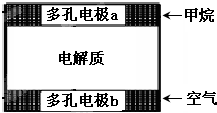 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- |
| C、在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com