
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
A. 33% B. 40% C. 50% D. 65%
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O物质的量之比为1∶2的混合溶液浸取锌焙砂时,生成[Zn(NH3)4]2+,该反应的离子方程式是 。浸取过程加入H2O2的目的是 。
(2)适量S2-能将Cu2+等离子转化为硫化物沉淀而除去,若选择置换的方法除杂,则应加入的物质为 。
(3)气体A的化学式是 。
(4)过滤3所得滤液可循环使用,其主要成分的化学式是 。证明2Zn(OH)2·ZnCO3沉淀洗涤完全的方法是 。
(5)为实现循环生产,下列物质中可以用来代替(NH4)2S完成除杂的是 。(填字母)
a.Na2S b.K2S c.BaS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活紧切相关。下列说法正确的是
A.棉花和木材的主要成分都是纤维素,蚕丝和合成纤维的主要成分都是蛋白质
B.石油干馏可得到石油气、汽油、煤油、柴油等
C.从海水中提取物质都必须通过化学反应才能实现
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_______时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(2)该反应原理的离子方程式为___________________________________;
(3)请将步骤③补充完整_________________________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点读数时俯视液面,则x值会________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
微粒代码 | a | b | c | d | e | f | g |
原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
带电荷数(单位电荷) | 0 | 1+ | 1﹣ | 0 | 2+ | 1+ | 0 |
其中:b的离子半径大于e的离子半径;d是溶于显碱性的四原子分子;g是常见的一种液体.试写出:
(1)a微粒的结构示意图是 .
(2)b与e相应元素的最高价氧化物的水化物的碱性强弱比较为:>(用化学式表示).
(3)d的水溶液显碱性的原因(用电离方程式表示) .
(4)c微粒的电子式 .
(5)b相应的元素的单质与g微粒反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是_________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)若大烧杯上不盖硬纸板,求得的反应热数值___________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热 ________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_______(填“偏大”、“偏小”或“无影响”)。
(6)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为2.2℃ 3.5℃ 3.3℃,则最终代入计算式的温差均值为______。已知溶液的比热容4.18J /(g.℃),计算中和热ΔH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
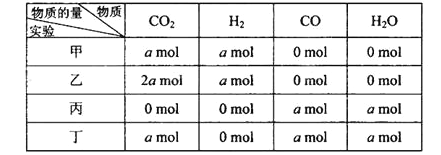
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A. 乙=丁>丙=甲 B. 乙>丁>甲>丙
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com