
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 过滤
过滤 洗涤
洗涤 过滤
过滤 洗涤
洗涤查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
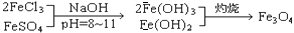
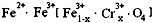 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.75mol/L | B.0.45mol/L | C.0.6mol/L | D.0.9mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
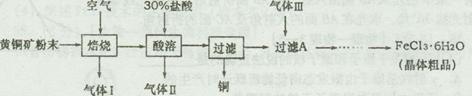
| A.O2 | B.H2 | C.Cl2 | D.N2 |
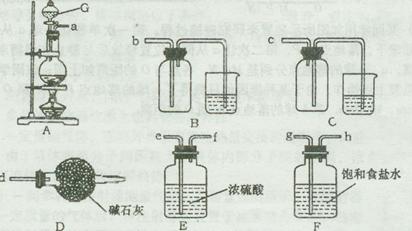
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.8g | B.5.6g | C.11.2g | D.1.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com