
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充):
组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
甲 | B |
|
|
|
|
|
|
|
乙 | D |
|
|
|
|
|
|
|
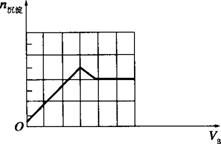
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。

(3)下图是上述某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲_________________(填化学式),乙____________________(填化学式)。

①若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度。
②若向500 mL乙溶液中滴加1 000 mL甲溶液时恰好得到6 mol(1<b<5)白色沉淀,试计算甲溶液中溶质的物质的量浓度。
【解析】(1)B(氢氧化钡溶液)+D(明矾溶液)![]() 自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+C(硫酸铝溶液)
自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+C(硫酸铝溶液)![]() 自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+E(混有少量硝酸的硫酸镁溶液)
自始至终都有白色沉淀(BaSO4);B(氢氧化钡溶液)+E(混有少量硝酸的硫酸镁溶液)![]() 自始至终都有白色沉淀(BaSO4);这三组中的甲、乙两种物质互相交换,又得到3种组合,共有6种组合(见答案)。
自始至终都有白色沉淀(BaSO4);这三组中的甲、乙两种物质互相交换,又得到3种组合,共有6种组合(见答案)。
(2)将氢氧化钡溶液逐滴加入明矾溶液中,当![]() 时,产生沉淀的物质的量最大,此时反应式为:
时,产生沉淀的物质的量最大,此时反应式为:
3Ba(OH)2+2KAl(SO4)2![]() 3BaSO4↓+2Al(OH)3↓+K2SO4;当
3BaSO4↓+2Al(OH)3↓+K2SO4;当![]() =2时,产生沉淀的物质的量最小,反应为:
=2时,产生沉淀的物质的量最小,反应为:
2Ba(OH)2+KAl(SO4)2![]() 2BaSO4↓+KAlO2+2H2O;产生1 mol Al(OH)3沉淀时需消耗3 mol OH-,溶解1 mol Al(OH)3沉淀时需消耗1 mol OH-,据此作出图象如下。
2BaSO4↓+KAlO2+2H2O;产生1 mol Al(OH)3沉淀时需消耗3 mol OH-,溶解1 mol Al(OH)3沉淀时需消耗1 mol OH-,据此作出图象如下。
(3)甲为Ba(OH)2,乙为HNO3和MgSO4的混合溶液时,符合给出的图示关系,原理:将Ba(OH)2溶液逐滴加入HNO3和MgSO4的混合溶液中,开始加入的Ba(OH)2将HNO3中和,产生的沉淀只有BaSO4;等到将HNO3完全被中和后再继续滴加Ba(OH)2溶液,在产生BaSO4沉淀的同时还会产生Mg(OH)2沉淀,图象中线的斜率增大(陡度增大);等到溶液中的![]() 完全沉淀后,再继续滴加Ba(OH)2溶液,只产生Mg(OH)2沉淀,此时图象中直线的斜率变小,当溶液中的Mg2+完全沉淀后,产生的沉淀量保持不变(图象保持水平)。
完全沉淀后,再继续滴加Ba(OH)2溶液,只产生Mg(OH)2沉淀,此时图象中直线的斜率变小,当溶液中的Mg2+完全沉淀后,产生的沉淀量保持不变(图象保持水平)。
①(0,0)—(1,1)之间,加入了1 mol Ba(OH)2,只产生了1 mol BaSO4沉淀,说明加入的OH-没有产生沉淀(即被硝酸中和了),根据中和反应关系Ba(OH)2—2HNO3可知,乙溶液中含有2 mol HNO3,则c(HNO3)=![]() =4 mol·L-1。(1,1)—(3,5)之间,又加入了2 molBa(OH)2,生成了4 mol沉淀,关系式为Ba(OH)2—BaSO4↓+Mg(OH)2↓。(3,5)—(4,6)之间,加入了1 mol Ba(OH)2,产生了1 mol Mg(OH)2沉淀,根据Ra(OH)2—Mg(OH)2↓可知,乙溶液中含有(2+1)molMgSO4,则c(MgSO4)=
=4 mol·L-1。(1,1)—(3,5)之间,又加入了2 molBa(OH)2,生成了4 mol沉淀,关系式为Ba(OH)2—BaSO4↓+Mg(OH)2↓。(3,5)—(4,6)之间,加入了1 mol Ba(OH)2,产生了1 mol Mg(OH)2沉淀,根据Ra(OH)2—Mg(OH)2↓可知,乙溶液中含有(2+1)molMgSO4,则c(MgSO4)=![]() =6 mol·L-1。
=6 mol·L-1。
②加入的Ba(OH)2溶液的体积为1 000 mL(即![]() =2,求出x=
=2,求出x=![]() ,则c[Ba(OH)2]=
,则c[Ba(OH)2]= ![]() mol·L-1。
mol·L-1。
【答案】(1)如下表:
组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
甲 | B | B | B | C | D | E |
|
|
乙 | D | C | E | B | B | B |
|
|
(2)只要作出一定的比例即可,突出纵坐标横坐标的两个沉淀过程的前后物质的量之比。
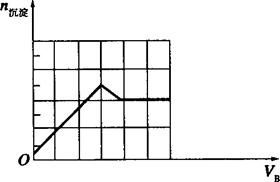
(3)甲:Ba(OH)2、乙:HNO3和MgSO4
①HNO3:4 mol·L-1、MgSO4 6 mol·L-1
②Ba(OH)2:![]() mol·L-1
mol·L-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2012-2013学年海南省琼海市嘉积中学高二下教学质量监测二化学卷(带解析) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。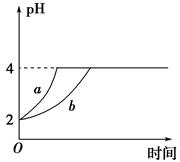
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源:2014届海南省琼海市高二下教学质量监测二化学卷(解析版) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。

(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g)![]() 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填
序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。


(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com