
| A. | SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料 | |
| B. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 | |
| C. | 盛放NaOH溶液的试剂用橡皮塞,而不用玻璃塞 | |
| D. | Si是良好的半导体材料,是将太阳能转换为电能的常用材料 |
分析 A.光导纤维的主要成分为二氧化硅;
B.SiO2与氢氟酸反应不是生成盐和水;
C.玻璃塞的主要成分为硅酸钠、二氧化硅等,二氧化硅和氢氧化钠反应生成硅酸钠和水;
D.硅是良好的半导体材料.
解答 解:A.水晶、玛瑙、光导纤维的主要成分为二氧化硅,故A正确;
B.二氧化硅和氢氟酸反应生成四氟化硅和水,四氟化硅不是盐,二氧化硅与氢氧化钠溶液反应生成盐和水,因此二氧化硅属于酸性氧化物,故B错误;
C.玻璃塞的主要成分为硅酸钠、二氧化硅等,盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,因为二氧化硅和氢氧化钠反应生成硅酸钠和水,故C正确;
D.硅是良好的半导体材料,用于制造太阳能,故D正确.
故选B.
点评 本题考查了物质的成分、试剂的保存、两性氧化物的概念,明确硅及其二氧化硅的性质、两性氧化物的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应物具有的总能量总是高于生成物所具有总能量 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 决定化学反应速率的主要因素是参加反应的物质的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 37% | ||
| C. | 50% | D. | 数据不全无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
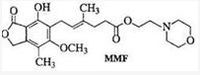
| A. | MMF能发生取代反应和消去反应 | |
| B. | 1 mol MMF能与6 mol 氢气发生加成反应 | |
| C. | 1 mol MMF能与含3 mol NaOH的水溶液完全反应 | |
| D. | MMF可与Na2CO3溶液反应生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体分散质粒子较大,不能透过滤纸 | |
| B. | 液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 纳米材料分散到液体分散剂中的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸检测,氨水溶液呈碱性:NH3•H2O=NH4++OH- | |
| B. | 100℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13 H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | FeCl3溶液中通入适量SO2,溶液黄色褪去:Fe3++SO2+2H2O=Fe2++SO42-+4H+ | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表第5列是第Ⅴ副族 | |
| B. | 元素周期表中所含元素种类最多的族是第Ⅷ族 | |
| C. | 第ⅠA族的元素就是碱金属元素 | |
| D. | 元素周期表中第4、5、6、7周期为长周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
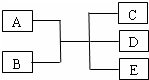 己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,
己知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com