
【题目】下列反应中,氧化剂与还原剂物质的量之比为 1∶2 的是 ( )
A.3S+6NaOH= 2Na2S+ Na2SO3+3H2O
B.2 CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2
C.I2+2NaClO3=2NaIO3+Cl2
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是
A.等物质的量的OH-和-OH中所含电子数
B.等质量的氧气和臭氧中含有的氧原子数目
C.1molNa2O2固体中阳离子与阴离子的数目
D.等物质的量的Cu与Fe分别与足量的稀硝酸反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D. 1 mol迷迭香酸最多能和6 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
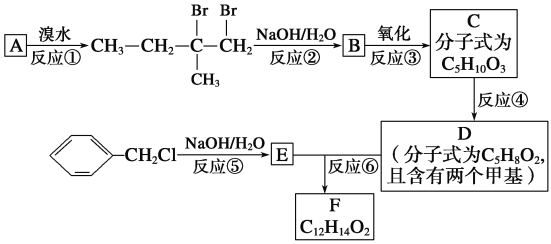
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;
⑥____________________________________________________________________。
(4)F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 mol碳正离子(CH3+)所含的电子总数为9NA
B.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
C.标准状况下,22.4 L己烷中共价键数目为19NA
D.1 mol雄黄(As4S4),结构如图: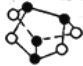 ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与FeSO4反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100 mL烧杯A中,加热水搅拌
②加入Na2CO3溶液10 mL使溶液pH为6.5~6.7。并将上述溶液移至100 mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入FeSO4溶液30 mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量。
请回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则B为_________(填字母),C为___________(填名称);

(2)己知反应容器中反应物FeSO4和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入Na2CO3溶液调节pH的目的是_____________,若加入Na2CO3溶液过量,对实验的影响是_____________;
(3)所需FeSO4溶液应现用现配,用FeSO4·7H2O固体配置FeSO4溶液的方法为:__________;
(4)写出容器B中制备富马酸亚铁的化学方程式:___________;
(5)步骤④检验沉淀是否洗净的方法是:________________;
ii. 计算产品的产率:
(6)经测定,产品中富马酸亚铁的纯度为76.5%、以5.80 g富马酸为原料反应制得产品8.50 g,则富马酸亚铁的产率为______________%(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com