
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀 |
分析 A.利用液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液氨常用作制冷剂;
B.汽车尾气中含有烟尘等颗粒物,化石燃料的燃烧等都会产生大气的污染,调整产业结构,尽量减少对化石燃料的使用,能够减少雾霾;
C.碳纤维是一种新型的无机非金属材料;
D.铝易于碱性溶液发生反应.
解答 解:A.利用液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液氨常用作制冷剂,故A正确;
B.汽车尾气中含有燃料不充分燃烧产生的烟尘等,污染了空气,能引起大气中PM2.5增大,化石燃料燃烧会产生CO、SO2和粉尘等有害气体,污染了空气,能引起大气中PM2.5增大,产生雾霾天气,调整产业结构,尽量减少对化石燃料的使用,能够减少雾霾,故B正确;
C.碳纤维是一种新型的新型无机非金属材料,故C正确;
D.铝易于碱性溶液发生反应,不耐碱,故D错误;
故选:D.
点评 本题考查了生活中的化学,涉及环境污染与治理、液氨的用途、常见的材料,题目难度不大,注意对相关知识的积累.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
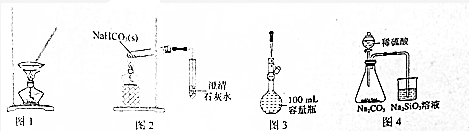
| A. | 用图1装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置来溶解、配置100mL•L-1NaCl溶液 | |
| D. | 用图4装置比较硫酸、碳酸、硅酸三种酸的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置验证 NaHCO 3 的不稳定性 | |
| B. | 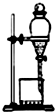 用图所示装置提取苯硝化反应后的产物 | |
| C. | 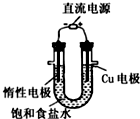 用图所示装置模拟氯碱工业生产氯气 | |
| D. | 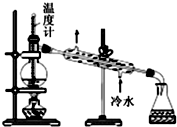 用图所示装置分馏石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
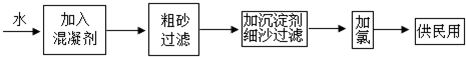
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
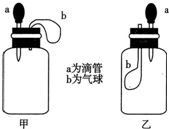 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )| A. | 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体) | |
| B. | 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气 | |
| C. | 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液 | |
| D. | 甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com