
����Ŀ������������Ԫ��A��B��C��D��E��F��ԭ��������������A��EԪ�ص�ԭ��������ֻ��һ�����ӣ���A��E���γ����ӻ����B������л�������ĺ���Ԫ�أ�C�ĵ����ǿ����к����������壻Dԭ�ӵ����������������ڲ��������3����F��Dͬ���塣��ش�
��1��A��D��E��ɵĻ����������ʽΪ_____��
��2��BԪ�������ڱ��е�λ����__��������ɵ�һ��ͬ������������ԭ�Ӿ��壬������Ϊ___��
��3��C��D�ļ��⻯�������ȶ��Խ�ǿ�����ʵ���ѧʽΪ____��
��4��E��F������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽΪ______��
���𰸡�![]() �ڶ����ڵ�IVA�� ���ʯ H2O H+ + OH-= H2O
�ڶ����ڵ�IVA�� ���ʯ H2O H+ + OH-= H2O
��������
����������Ԫ��A��B��C��D��E��F��ԭ��������������A��EԪ�ص�ԭ��������ֻ��һ�����ӣ���A��E���γ����ӻ�������A��H��E��Na��B������л�������ĺ���Ԫ�أ�B��C��C�ĵ����ǿ����к����������壬C��N��Dԭ�ӵ����������������ڲ��������3����D��O��F��Dͬ���壬F��S���ݴ˽��
�������Ϸ�����֪����������Ԫ��A��B��C��D��E��F�ֱ���H��C��N��O��Na��S����
��1��A��D��E��ɵĻ����������ӻ������������ƣ�����ʽΪ![]() ��
��
��2��BԪ����C�������ڱ��е�λ���ǵڶ����ڵڢ�A�壬������ɵ�һ��ͬ������������ԭ�Ӿ��壬������Ϊ���ʯ��
��3����Ԫ�طǽ�����ǿ�ڵ�Ԫ�أ��ǽ�����Խǿ���⻯��Խ�ȶ�����C��D�ļ��⻯�������ȶ��Խ�ǿ��������ˮ����ѧʽΪH2O��
��4��E��F������������Ӧ��ˮ����ֱ����������ƺ����ᣬ���߷�Ӧ�����ӷ���ʽΪH++OH-��H2O��


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�ͨ���û���Ӧ�õ��������ʵ���
A.�ƿ�Ͷ���Ȼ�ͭ��Һ��B.һ����̼ͨ�����ȵ�����ͭ
C.��̿��ʯӢ��ϸ��¼���D.����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Cl2ͨ������NaOH��Һ�������п�����NaCl��NaClO��NaClO3����![]() ��ֵ�����¶ȸߵ��йأ���n(NaOH)��6a molʱ�������й�˵����ȷ����
��ֵ�����¶ȸߵ��йأ���n(NaOH)��6a molʱ�������й�˵����ȷ����
A. �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���n�ķ�Χ��3a mol��n��5a mol
B. �ı��¶ȣ�������NaCl����С���۲���Ϊ4a mol
C. �μӷ�Ӧ�����������ʵ���Ϊ6a mol
D. ij�¶��£�����Ӧ��![]() ��6������Һ��
��6������Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�
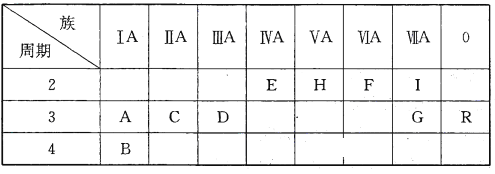
����Ҫ��ش��������⣺
��1��ʮ��Ԫ���л�ѧ��������õ�Ԫ����__________________����Ԫ�ط��ţ���ͬ�����γɻ�������������Ԫ����_____________________��
��2��A��C��D����Ԫ�ص�����������Ӧ��ˮ������м�����ǿ����______________���ѧʽ����ͬ����E��H��G����Ԫ�ص�����������Ӧ��ˮ������������ǿ����______________��
��3��IԪ�ظ�AԪ���γɻ�����ĵ���ʽ��______________���������ոû�����ʱ�������______________ɫ��
��4���ֱ�д��B��G���ֵ��ʺ�ˮ��Ӧ�����ӷ���ʽ_____________��________________��
��5��Ԫ��A��F���γ����ֻ����д�����н��ȶ��Ļ�������CO2��Ӧ���������Ļ�ѧ����ʽ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȷ�(CHCl3)���治�����������������綾�����(COCl2)����ӦΪ2CHCl3+O2��2HCI+2COCl2.�����ĽṹʽΪ![]() ������˵������ȷ����
������˵������ȷ����
A. ʹ��ǰ����������ϡ��Һ�����ȷ��Ƿ����
B. CHCl3����Ϊ�����Լ��ķǼ��Է���
C. COCl2����������ԭ�ӵ��������Ӷ�����8���ӽṹ
D. COCl2�����к���3��������1������������̼ԭ�Ӳ���sp�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ij�л�������A�Ľṹ�����ʣ���������ʵ�飺
I.ȷ������ʽ
��1�����л���A�����������г��ȼ��ʵ���ã�����5.4gH2O��8.8gCO2����������6.72L(��״����)����A�и�Ԫ�ص�ԭ�Ӹ�����Ϊ______________��
��2��A������ͼ��ͼ1��ʾ����A�ķ���ʽΪ_____________��
II.�ṹʽ��ȷ��
��3�����ⶨ��A�ĺ˴Ź�������ͼ��ͼ2��ʾ����A�Ľṹ��ʽΪ____________��
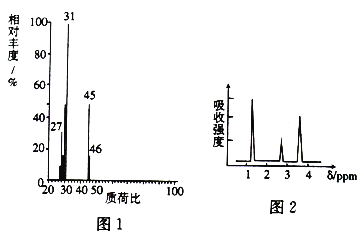
III.����ʵ��
��4��A��һ�������¿���ˮ������ɫ����B���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
��5�����������е��˶�Ա����Ť��ʱ����ҽ�漴��������(�е�Ϊ12.27��)�����˲�λ���оֲ��䶳�������Ʊ��������һ���÷�������A��SOCl2�����·�Ӧ��ͬʱ���ɶ���������Ȼ����������壬��÷�Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������������ȷ����
A. pH=0����Һ������B. ������Һ�У�c(H+)Խ��pHԽ��
C. pH=7����Һһ��������D. 0.1mol/L������������Һ����pH=13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ơ��صȽ��������Ż�ʱ���������������ǣ� ��
A. ˮ B. ú�� C. ɳ�� D. ��ĭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 100g46%����(HCOOH)ˮ��Һ��������ԭ����Ϊ5NA
B. ��״����,18g��ˮ�й��ۼ�����ĿΪNA
C. 56g����71gCl2��ַ�Ӧ��ת�Ƶ�����ĿΪ3NA
D. 7.8gNa2O2��������ˮ(H218O)��Ӧ���ɵ�����������������Ϊ0.5NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com