
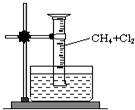
 某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白:
某研究小组为了探究甲烷和氯气反应的情况,设计了如下实验.请填写下列空白:分析 (1)氯气与甲烷发生取代反应,生成氯代烃、HCl,HCl易溶于水;
(2)甲烷中氢原子被氯原子取代生成氯代甲烷,该反应为取代反应;
(3)甲烷与氯气在光照条件下能够发生取代反应,第一步反应为甲烷中1个H被氯原子取代生成一氯甲烷,据此写出反应的化学方程式;
(4)水槽中的液体必须满足:氯气在该溶液中溶解度很小,以便证明氯气与甲烷发生了反应;
(5)氯水中含有氯离子,加入硝酸银溶液同样产生氯化银沉淀,干扰了氯离子的检验.
解答 解:(1)氯气与甲烷发生取代反应,生成氯代烃、HCl,HCl易溶于水,可观察到量筒内形成一段水柱,气体颜色变浅,有油状液滴生成,
故答案为:气体颜色变浅,有油状液滴生成;
(2)甲烷与氯气的反应属于取代反应,故答案为:取代反应;
(3)甲烷中一个氢原子被氯气取代的反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
(4)Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;由于氯气在水中溶解度较大、氯水能够与饱和石灰水、饱和碳酸氢钠溶液反应,干扰的实验结果,而不能使用水,更不能使用饱和石灰水、饱和碳酸氢钠溶液,
故答案为:C;
(5)氯水中存在化学平衡:Cl2+H2O?H++Cl-+HClO;次氯酸是弱电解质,溶液中存在三种分子:Cl2、HClO、H2O;四种离子:H+、Cl-、ClO-、OH-(少量),所以当氯水中加入AgNO3溶液时会发生反应:Ag++Cl-=AgCl↓,同样会产生白色沉淀,干扰了氯离子的检验,
故答案为:氯水中加入AgNO3溶液也会产生白色沉淀.
点评 本题考查性质实验设计,涉及甲烷的取代反应、有机反应类型的判断等知识,题目难度中等,注意掌握甲烷的化学性质及甲烷与氯气发生取代反应的原理,明确物质检验方案设计必须满足严密性.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和H2SO4;Cu(OH)2和CH3COOH | B. | Ba(OH)2和Na2SO4;Ba(OH)2和CuSO4 | ||
| C. | NaOH和H2SO4;NaOH和NaHSO4 | D. | Na2CO3和盐酸;NaHCO3和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 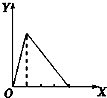 向NaOH溶液中逐滴加入AlCl3溶液至过量且边滴边振荡 | |
| B. | 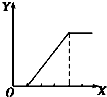 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| C. | 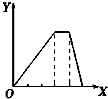 向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 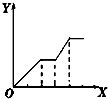 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
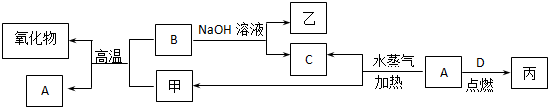
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2分子比H原子更稳定 | |
| B. | 可求出Cl-Cl 的键能为428 kJ/mol | |
| C. | 1mol氢气与1mol氯气所含的总能量比2mol HCl所含的总能量高 | |
| D. | 理论上利用此反应制取盐酸的同时,可依据原电池原理获取电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com