
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B. 2.24LCl2与CH4在光照下反应生成的HCl分子数为0.1NA
C. 常温下,0.1mol环氧乙烷(![]() )中含有的共价键数为0.3NA
)中含有的共价键数为0.3NA
D. 4.2gCaH2与水完全反应,转移的电子数为0.1NA
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 表示硫的燃烧热的热化学方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物M的合成路线如下:

已知:![]()
(1)A中含氧官能团的名称是______。
(2)反应①的试剂和条件为_______,B的结构简式为______。
(3)D为酯类,以乙醛为原料,写出合成D所涉及的化学方程式______。
(4)2 D → E + C2H5OH,F中含有醇羟基,写出下列物质的结构简式:E________ F________G___
(5)反应①~⑥中属于取代反应的有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:


①第一步反应是______________(填“放热”或“吸热”)反应,判断依据是___________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2(填“>”、“<”或“=”)。
(3)在298 K、101 kPa时,已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
(4)已知:
①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________。
O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________。
(5)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:

则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;发生装置B应选择以下三种装置中的________(选填序号)。

(2)D装置中主要反应的离子方程式为_______________________
(3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液
若Cl2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,再加入________(选填一个序号)试剂。发生的现象是______________。若SO2过量,取适量D中溶液滴加至盛有________(选填一个序号)试剂的试管内,发生的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A. 加入适量的NaCl,可使c(NH![]() )=c(Cl-)
)=c(Cl-)
B. 滴加几滴浓氨水,c(NH![]() )减小
)减小
C. 滴加几滴浓盐酸,![]() 的值减小
的值减小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH![]() )比该混合溶液中的大
)比该混合溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO是一种药物合成的中间体,可通过CH3CH2OH+4Cl2→CCl3CHO+5HCl进行制备。制备时可能发生的副反应为C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH+HCl。合成该有机物的实验装置示意图(加热装置未画出)和有关数据如下:
物质 | C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |

(1)恒压漏斗A的作用是________;A装置中发生反应的化学方程式为________。
(2)装置B的作用是________;装置F在吸收气体时,为什么可以防止液体发生倒吸现象。________。
(3)装置E中的温度计要控制在70 ℃,三口烧瓶采用的最佳加热方式是______。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水应该从________(填“a”或“b”)口通入。实验使用球形冷凝管而不使用直形冷凝管的目的是_______。
(4)实验中装置C中的试剂是饱和食盐水,装置中D的试剂是浓H2SO4。如果不使用D装置,产品中会存在较多的杂质________(填化学式)。除去这些杂质最合适实验方法是_______。
(5)利用碘量法可测定产品的纯度,反应原理如下:
CCl3CHO+NaOH=CHCl3+HCOONa HCOONa+I2=HI+NaI+CO2↑ I2+2Na2S2O3=2NaI+Na2S4O6
称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,调节溶液为合适的pH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL,则该次实验所得产品纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
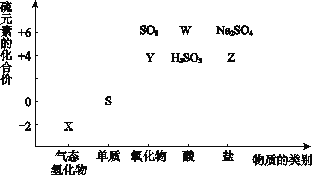
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com