

分析 A为常见的非金属固体单质,E为常见的金属单质,溶液F和氯水反应得到棕黄色溶液说明生成的是三价铁盐溶液,沉淀G为Fe(OH)3,溶解于酸D生成溶液H,和金属E反应又生成F判断金属具有变价,F为低价金属的盐溶液为亚铁盐溶液,则推断D和金属E腐蚀反应、生成低价亚铁盐溶液,酸D为H2SO4,A为S,B为SO2,C为SO3,D为H2SO4,据此分析回答问题;
(1)上述分析判断B为二氧化硫,沉淀G为氢氧化铁,棕黄色溶液中主要溶质为氯化铁溶液;
(2)H与E反应是铁和氯化铁反应生成氯化亚铁;
(3)在酸性的F溶液为硫酸亚铁,溶液中通入氧气,也能生成棕黄色溶液硫酸铁溶液;
解答 解:A为常见的非金属固体单质,E为常见的金属单质,溶液F和氯水反应得到棕黄色溶液说明生成的是三价铁盐溶液,沉淀G为Fe(OH)3,溶解于酸D生成溶液H,和金属E反应又生成F判断金属具有变价,F为低价金属的盐溶液为亚铁盐溶液,则推断D和金属E腐蚀反应、生成低价亚铁盐溶液,酸D为H2SO4,A为S,B为SO2,C为SO3,D为H2SO4,据此分析回答问题;
(1)上述分析判断B为二氧化硫,化学式为SO2,沉淀G为氢氧化铁,化学式为Fe(OH)3,棕黄色溶液中主要溶质为硫酸铁和氯化铁溶液,化学式为Fe2(SO4)3,FeCl3,
故答案为:SO2,Fe(OH)3,Fe2(SO4)3,FeCl3;
(2)H与E反应是铁和氯化铁反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)在酸性的F溶液为硫酸亚铁,溶液中通入氧气,也能生成棕黄色溶液硫酸铁溶液,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
点评 本题考查了无机物转化关系和物质性质的理解应用,主要是变价金属发生的反应分析判断,溶液颜色变化特征是解题关键,题目难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl常用于保存食物 | |
| B. | 烹鱼时加入少量酒、食醋,美味又营养 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 燃煤中加入CaCO3,可减少SO2气体对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 816O2是818O2的同分异构体 | B. | 818O2是O3的一种同素异形体 | ||
| C. | 816O2与818O2互为同位素 | D. | 1mol 818O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO | B. | NaCl | C. | SiO2 | D. | K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
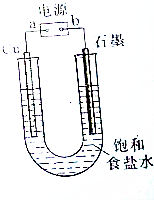 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na,而与金属钠反应时生成C5H8O3Na2;则与该有机物具有相同官能团的同分异构体的种类(不考虑立体异构)有
A.10种
B.11种
C.12种
D.13种
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
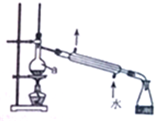
| A. | 仪器a为圆底烧瓶 | B. | 可用于实验室蒸馏石油 | ||
| C. | 可用于分离苯和溴苯的混合物 | D. | 可用于分离乙酸和乙醇的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com