
【题目】下列说法正确的是
A. 高纯度的SiO2是制备光导纤维、太阳能电池板的主要材料
B. NO2有氧化性,可以损害多种织物和尼龙制品
C. Al2O3熔点高,一般采用电解熔融的AlCl3制备金属铝
D. 利用Na2CO3可与盐酸反应的原理,治疗胃酸过多
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是
A.同密度、同压强的CO和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和N2
D.同压强、同体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO![]() ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关叙述中,正确的是
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关叙述中,正确的是
A.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO![]()
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=3Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。如图是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 (选序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(2)发生器中产生ClO2的离子反应方程式为 。
(3)吸收塔内反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2 外,还可以选择的还原剂是 (选序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (选序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
若A在常温下为气体,C是红棕色的气体。
(1)A、C的化学式分别是:A__________、C__________。
(2)D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式______________________;该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液酸性增强
C. 加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D. 加入少量水,水的电离平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,运用铁及其化合物的知识,完成下列问题。
(1)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________。某问学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少最待侧溶液,滴入KSCN溶液后显红色。由此可知,该溶液中所含金属阳离子有_________。
(2)欲从废液中回收铜,并重新获得FeCl3溶液。某同学设计如下实验方案:

①写出上述实验中有关物质的化学式:A_______;B___________。
②写出通入气体C的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
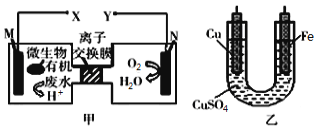
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
D.当N电极消耗0.25mol气体时,则铁电极增重16g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com