
分析 (1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,根据关系式:5C2O42-~5H2C2O4~2KMnO4计算n(C2O42-),再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-计算n(Fe3+),根据n (Fe3+):n (C2O42-)确定y的值,再根据电荷守恒确定x,进而确定化学式;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水;
(4)根据化合价代数和为0,计算MnFe2O4-x中铁的总价态,令1mol MnFe2O4-x中含Fe2+、Fe3+物质的量分别为xmol、ymol,列方程组解答.
解答 解:(1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,
根据关系式:5C2O42-~5H2C2O4~2KMnO4,可知n(C2O42-)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×0.1020×24.48×10-3 mol,
再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-,可知n (Fe3+)=n( Fe2+)=5n(MnO4-)=5×0.1020×4.08×10-3 mol,
故n (Fe3+):n (C2O42-)=1:3,所以y=3,由电荷守恒可知x+3=2y,即x+3=3×2,解得x=3,
故化学式为 K3Fe(C2O4)3•3H2O,
故答案为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,K3Fe(C2O4)3•3H2O;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵,反应离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水,化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,
故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O;
(4)x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,设1mol MnFe2O3.4中含Fe2+、Fe3+物质的量分别为xmol、ymol,
则有x+y=2,2x+3y=4.8,
联立解得:x=1.2,y=0.8,
则1mol MnFe2O3.6中含Fe2+的物质的量为1.2mol,则Fe2+占的百分率为$\frac{1.2mol}{2mol}$×100%=60%.
故答案为:60%.
点评 本题考查氧化还原反应滴定计算、方程式书写、物质组成的计算等,(1)中计算量较大,注意利用关系式计算,需要学生具备扎实的基础,难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是113 | ||
| C. | 该核素的中子数为72 | D. | 该元素的相对原子质量为了185 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SrO可与盐酸反应 | B. | Sr(OH)2难溶于水 | C. | SrSO4难溶于水 | D. | Sr(OH)2是强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 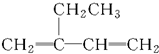 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 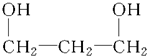 1,3-二丙醇 1,3-二丙醇 | D. | 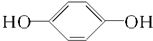 1,4-苯二酚 1,4-苯二酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com