
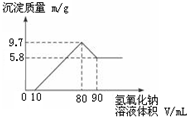
 将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.
将一定质量的镁铝合金投入200mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入NaOH溶液体积的关系如图.分析 (1)由图可知,从加入10mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为80mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠70mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.08L-0.01L)×5mol/L=0.35mol.从加入氢氧化钠溶液80mL~90mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.09L-0.08L)×5mol/L=0.05mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量.
(2)加入氢氧化钠溶液为80mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从加入10mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为80mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠70mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.08L-0.01L)×5mol/L=0.35mol.从加入氢氧化钠溶液80mL~90mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.09L-0.08L)×5mol/L=0.05mol,故3×0.05mol+2n[Mg(OH)2]=0.35mol,解得n[Mg(OH)2]=0.1mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.1mol,所以Mg的质量为:0.1mol×24g/mol=2.4g,铝的质量为:27g/mol×0.05mol=1.35g,
所以合金中镁和铝的质量比为:2.4g:1.35g=16:9,
故答案为:16:9;
②加入氢氧化钠溶液为80mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.08L×5mol/L=0.4mol,根据氯元素守恒n(HCl)=0.4mol,故盐酸的物质的量浓度为:$\frac{0.4mol}{0.2L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
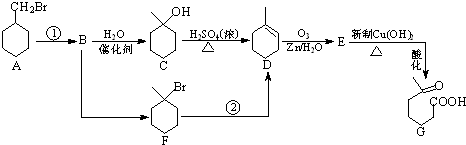
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃(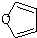 )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为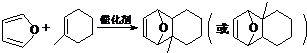 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,则金刚石比石墨稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则含20 g NaOH的稀溶液与稀醋酸恰好完全反应,放出的热量为28.7 kJ | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则碳的燃烧热等于110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能由pH=2的盐酸与pH=12的氨水等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的盐酸和氨水等体积混合而成 | |
| C. | 加入适量氨水,溶液中离子浓度可能为:c (NH4+)>c (Cl-)>c (OH-)>c(H+) | |
| D. | 该溶液中c (NH4+)=c (Cl-)+c (OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者与盐酸反应的速率相同 |
| B | 将0.1mol•L-1Na2CO3溶液滴入BaCl2溶液至不再有沉淀产生,再滴加0.1mol•L-1Na2SO4溶液 | 有白色沉淀并保持不变 | BaCO3不能转化为BaSO4 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将Kl和FeCl3溶液在试管中混合后,加入庚烷,振荡,静置 | 下层溶液显紫红色 | 生成的l2全部溶于庚烷中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
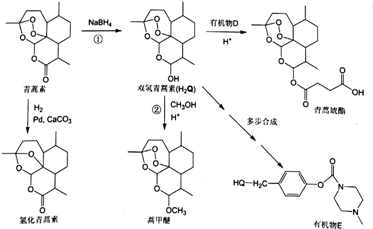
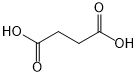 (或
(或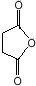 ).
). .
.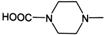 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为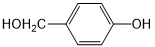 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲溶液中SO42ˉ向铜片做定向移动 | |
| C. | 装置乙中电子从铜片经导线流向锌片 | |
| D. | 装置乙中正极的电极反应式:2H++2eˉ═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com