
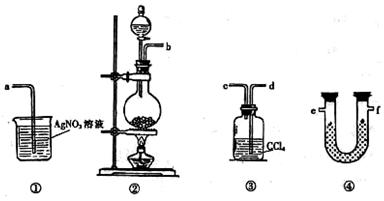
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.碱式滴定管 | B.50mL量筒 | C.10mL量筒 | D.25mL移液管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
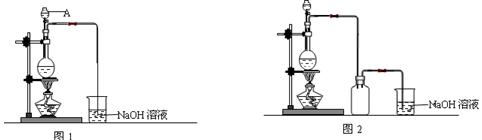
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑧ | B.①②⑦ | C.③④⑥ | D.⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.过滤 | B.蒸发 | C.分液 | D.萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石油分馏时把温度计插入液面下 |
| B.向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制银镜 |
| C.在试管内加入少量蔗糖溶液,再加3-5mL稀硫酸小心煮沸几分钟后冷却,加入新制Cu(OH)2悬浊液,煮沸,有红色沉淀生成 |
| D.用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com