
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
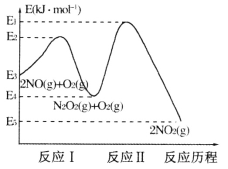
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
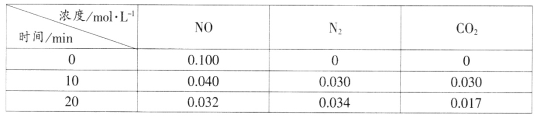
①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
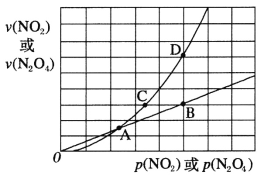
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
【答案】2NO(g)![]() N2O2(g) △H=-(E3-E4)kJ·mol-1 反应Ⅱ 温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢 0.56 减小二氧化碳浓度 < k1=2k2·KP BD 达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)
N2O2(g) △H=-(E3-E4)kJ·mol-1 反应Ⅱ 温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢 0.56 减小二氧化碳浓度 < k1=2k2·KP BD 达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)
【解析】
(1)①根据△H=生成物的总能量减反应物总能量计算。
②反应快慢主要由活化能决定,分析温度升高对两个反应的影响。
(2)①T℃时,根据平衡常数表达式进行计算。
②分析得出NO、CO2量比原来减少,氮气比原来增加即得结论。
③再充入NO和N2,使二者的浓度均增加至原来的两倍,根据浓度商计算得到,再与配合常数比较得出。
(3)平衡时v(NO2) 正= 2v(N2O4)逆代入可得到关系式,B、D点,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4),因此反应达到平衡状态。
(1)①△H=E4 kJ·mol-1-E3kJ·mol-1 =-(E3-E4)kJ·mol-1,因此反应I的热化学方程式2NO(g)![]() N2O2(g) △H=-(E3-E4)kJ·mol-1,故答案为:2NO(g)
N2O2(g) △H=-(E3-E4)kJ·mol-1,故答案为:2NO(g)![]() N2O2(g) △H=-(E3-E4)kJ·mol-1。
N2O2(g) △H=-(E3-E4)kJ·mol-1。
②活化能越大,反应速率越慢,反应Ⅱ的活化能大,因此决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢,故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
2NO2(g)反应速率的是反应Ⅱ;对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢,故答案为:反应Ⅱ;温度升高后反应I平衡逆向移动,导致N2O2浓度减小,温度升高对反应Ⅱ的影响弱于N2O2浓度减小的影响,导致反应Ⅱ速度变慢,最终总反应速率变慢。
(2)①T℃时,该反应的平衡常数为![]() ,故答案为:0.56。
,故答案为:0.56。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,NO、CO2量比原来减少,氮气比原来增加,则改变的条件是减小二氧化碳浓度,故答案为:减小二氧化碳浓度。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,![]() ,此时反应v正 < v逆,故答案为:<。
,此时反应v正 < v逆,故答案为:<。
(3)一定温度下,平衡时v(NO2) 正= 2v(N2O4)逆即k1·p2(NO2) = 2k2·p(N2O4),k1=2k2·KP,因此k1、k2与平衡常数kp间的关系是k1=2k2·KP;在上图标出点中,B、D点,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4),因此能表示反应达到平衡状态的点是BD,理由是达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4);故答案为:2k2·KP;BD;达到平衡时,N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)。


科目:高中化学 来源: 题型:
【题目】铁和氧化铁的混合物共2mol,加盐酸后固体全部溶解,共收集到0.5molH2,且溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A.0.5molB.1.5molC.0.75molD.1.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为原料合成有机化合物M和N的路线如下:
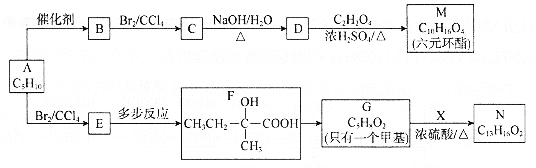
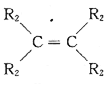
已知:a.在催化剂作用下,烯烃分子间的双键碳原子可以互换而发生烯烃复分解反应: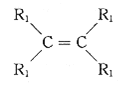 +
+
![]() 2
2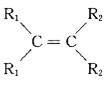
b.X的苯环上有2种等效氢,且只含1个甲基。
回答下列问题:
(1)根据系统命名法,B的名称是________。N中含氧官能团的名称为________。
(2)M的结构简式是________。
(3)F→G的反应类型是________。
(4)写出C→D的化学方程式________。
(5)同时满足下列两个条件的N的同分异构体共有________种;
①能够发生银镜反应且该物质与生成Ag的物质的量之比为1:4;
②苯环上连接—C5H11。
上述同分异构体中,核磁共振氢谱有5组峰且峰面积之比为9:2:2:2:1的有________和________(写结构简式)
(6)写出以CH2=CH(CH2)4CH=CH2为原料制备![]() 的合成路线________(其他试剂任选)
的合成路线________(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
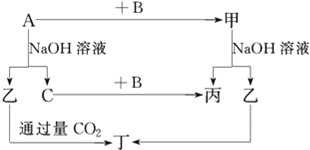
根据图示转化关系回答:
(1)写出下列物质的化学式。
A___,B___,乙___,丁___。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式___。
②甲与NaOH溶液反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50mL某AlCl3溶液加入30mL1mol/LNaOH溶液或50mL1.8mol/LNaOH溶液中,均能得到0.78g白色沉淀,则此AlCl3溶液的浓度是()
A.0.5 mol/LB.0.4 mol/LC.0.3 mol/LD.0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
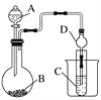
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com