
8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。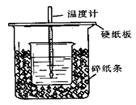
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (偏大、偏小、无影响)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,
所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(1)、环形玻璃搅拌棒(器)(2)、保温隔热,防止热量散失(3)、偏小
(4)、不相等、相等、中和热指稀的强酸和强碱溶液只生成1摩尔水所放出的热,与酸碱用量无关 (5)、偏小
解析试题分析:(1)为使测量结果更准确,反应必须充分,所以通常用环形玻璃搅拌棒加以搅拌使反应迅速充分反应;(2)为减少实验过程中的热最损失,通常会在烧杯间填满碎纸条,来达到保温、隔热的效果;(3)大烧杯上如不盖硬纸板,热量会有较大损失。求得的中和热数值偏小;
(4)60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应生成0.55mol水,而上述实验生成0.50mol水,放出的热量不相等;中和热是指稀溶液中强酸与强碱发生中和反应生成lmol H2O所放出的热量,与酸、碱用量无关。故选相等;(5)氨水属于弱碱,电离需要吸收大量热量,故测得中和热数值会偏小。
考点:考查中和热的测定。


科目:高中化学 来源: 题型:实验题
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程 中放出的热量可计算中和热。回答下列问题: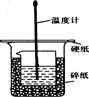
(1)烧杯间填满碎纸条的作用是 。
(2)从实验装置上看,图中缺少的仪器是 。
(3)实验中若用70mL0.50mol·L-1盐酸跟70mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
| A.大于25.3% | B.小于25.3% | C.等于25.3% | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgCl> AgBr>AgI |
| C.AgBr >AgCl>AgI | D.AgBr >AgI>AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(9分)某同学设计了如下实验探究盐的水解反应规律。
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因: ;
简述测定该溶液的pH的操作方法是:
(3)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com