
下列说法正确的是( )。
A.C4H10有三种同分异构体
B.乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体
C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
D.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:选择题
二氯化二硫(S2C12)分子中的各原子最外层电子数均满足8电子,易与水反应:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应下列说法正确的是( )
A.1molS2C12价电子数为66NA
B.氧化产物与还原产物的物质的量之比为l : 7
C.每生成l mol SO2转移4 NA电子
D.每生成48g硫单质会断裂5NA共价键
查看答案和解析>>
科目:高中化学 来源:2016届天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
草酸(H2C2O4)广泛存在于食品中,人们对其及相关产品进行了深入研究。
(1)H2C2O4 (s) 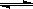 H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
H2O(g)+CO(g)+CO2(g) △H=+340kJ·mol-1,写出此反应的平衡常数表达式 K= ;密闭容器中,保持温度不变,下列有关选项正确的是( )
A.恒容时,容器的压强不再变化,说明该反应已达到化学平衡状态
B.恒压时,容器的体积不再变化,说明该反应已达到化学平衡状态
C.气体摩尔体积不再发生变化,说明该反应已达到化学平衡状态
D.气体平均摩尔质量不再发生变化,说明该反应已达到化学平衡状态
(2)草酸分解所需燃料可以是CO,通过甲烷制备CO:
CH4(g)+CO2(g)? 2CO(g)+2H2(g) △H >O。常温下,在2 L的密闭容器中通入4 mol CH4气体和6 mol CO2气体发生反应,5min后达到平衡,测得CO气体的浓度为0.1 mol·L-1。
①平衡时,该反应的平均反应速率v(CO2)= mol·L-1min-1。
②在不改变反应混合物用量的前提下,为了提高CH4气体的转化率,可采取的措施是 。
(3)电解饱和草酸溶液可以制得高档香料乙醛酸(H2C2O3),装置如下图1所示,写出复合膜电极的电极反应式 。
(4)在K3Fe(C2O4)3溶液中存在:[Fe(C2O4)3]3-?Fe3++3C2O42-,常温下,该溶液中
[Fe(C2O4)3]3-的浓度与温度的关系如上图2所示,则A点的c(Fe3+) B点的c(Fe3+) (填“<”“>”或“=”);草酸是一种温和的还原剂,其他条件不变,向K3Fe(C2O4)3溶液中加入少量KMnO4固体,Fe3+的浓度 (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:选择题
“矿石熊猫”由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为
X3Y2(ZWR4)3T2。其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>T B.XR2、WR2两种化合物中R的化合价相同
C.气态氢化物的稳定性:W<R<T D.最高价氧化物对应的水化物的碱性:X>Z
查看答案和解析>>
科目:高中化学 来源:2016届天津市和平区高三第二次模拟考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
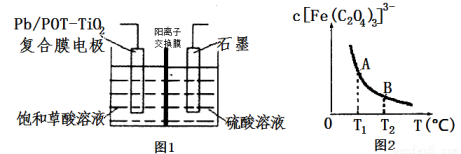
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO 4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:实验题
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
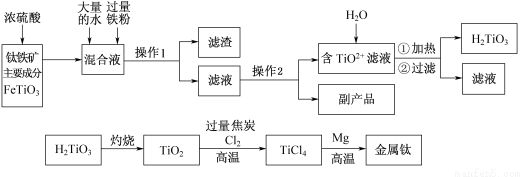
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝与锌之间,估计钛能耐腐蚀的原因之一是 。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三4月质检理综化学试卷(解析版) 题型:选择题
X 、Y 、Z 、R是四种短周期主族元素,X原子最外层电子数是次外层的2倍,Y元素在地壳中含量最多,Z元素金属性最强,R原子的核外电子数是X、Z核外电子数之和。下列叙述一定正确的是
A.含氧酸酸性R>X B.简单氢化物稳定性Y<X
C.最高正化合价Z< X <Y< R D.由Z和R形成的化合物为离子化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:填空题
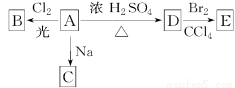
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
①A分子中的官能团名称是____________;
②A只有一种一氯取代物B,写出A的结构简式:____________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式是
______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化反应 ③加聚反应 ④水解反应[
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到分子式为C10H12O2Na2的化合物。“TBHQ”的结构简式是____________________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:填空题
氮化铝(AlN)是一种新型无机非金属材料。某A1N样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:A1N+NaOH+H2O===NaA1O2+NH3↑
[方案Ⅰ]取一定最的样品,用以下装置测定样品中AlN的纯度(夹持仪器已略去)。
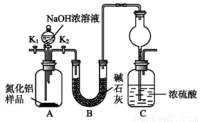
(1)上图C装置中球形干燥管的作用是________________________;
(2)完成以下实验步骤:组装好实验装置,首先________________再加入实验药品,接下来的实验操作是______________,打开分液漏斗活塞,加入 浓溶液,至不再产生气体.打开 K1,通入氨气一段时间,测定C装置反应前后的质量变化•通入氮气的目的是________________________;
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见________________________;
【方案二】
用下图装置测定mg样品中A1N的纯度(部分夹持装置已略去);
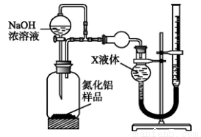
(4)为测定生成气体的体积,量气装置中的X液体可以是_________;
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则A1N的质量分数____________________;
【方案三】
按下图步骤测定样品中A1N的纯度:

(6)步骤②生成沉淀的离子方程式为________________________;
(7)若在步骤③中未洗涤,测定结果将___________(填“偏高”“偏低’或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com