
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于 ( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高中化学创新训练上专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列与实验相关的叙述正确的是 ( )。
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.将SO2和Cl2按等物质的量比通入品红溶液中,品红很快褪色
C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
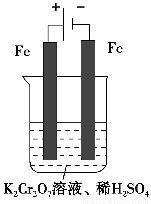
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72-的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:填空题
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+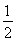 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
下表列出了A~R十种元素在周期表中的位置:
主族
周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA
2ERF
3ACDHIG
4B
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
下列关于指定粒子构成的叙述中,不正确的是 ( )。
A.37Cl与39K具有相同的中子数
B.第114号元素的一种核素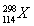 与
与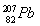 具有相同的最外层电子数
具有相同的最外层电子数
C.H3O+与OH-具有相同的质子数和电子数
D.O22-与S2-具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )。
A.1 mol Al3+含有的核外电子数为3NA
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.室温下,10 L pH=1的硫酸溶液中含有的H+数为2NA
D.室温下,10 L pH=13的NaOH溶液中含有的OH-数为NA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
欲鉴别物质的量浓度都为0.1 mol·L-1的KCl、(NH4)2SO4、NH3·H2O和H2SO4四瓶无色溶液,下列实验方案最佳的是 ( )。
A.用pH试纸鉴别
B.分别用闻气味和pH试纸鉴别
C.分别用BaCl2和NaOH溶液鉴别
D.用Ba(OH)2溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com