
| A. | b>a>c | B. | c>a>b | C. | c>b>a | D. | a>b>c |
分析 硫酸的密度比水大,溶液浓度越大,密度越大,氨水密度比水小,溶液浓度越大,密度越小,假设两种溶液的质量分数分别是x y,其中x<y,若把题中两种硫酸等体积混合想象成熟知的等质量混合(化陌生为熟悉),则混合后溶液中溶质的质量分数为$\frac{x+y}{2}$.硫酸越浓,密度越大,故等体积混合时,较浓硫酸的质量比混合溶液的质量一半要多,所以混合后溶液中溶质的质量分数应大于$\frac{x+y}{2}$,氨水密度比水小,情况和硫酸相反,以此解答该题.
解答 解:假设两种溶液的质量分数分别是x y,其中x<y,
对于硫酸溶液,
等质量(假设都是m g)混合之后,混合溶液质量分数=$\frac{mx+my}{2m}$=$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的硫酸密度比较小,等体积的两种硫酸,质量分数大的质量大,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的高质量分数组分的硫酸,因此混合溶液质量分数>$\frac{x+y}{2}$;
同样,对于氨水溶液,
等质量混合时其浓度依然是$\frac{x+y}{2}$,
等体积混合时,由于质量分数小的氨水溶液密度比较大(因为氨水的密度比水小),等体积的两种氨水溶液,质量分数大的质量小,那么等体积混合相当于先将二者等质量混合,然后再加入一定量的低质量分数组分的氨水溶液,因此混合溶液质量分数<$\frac{x+y}{2}$.
则有b>a>c,
故选A.
点评 本题考查了溶质质量分数的计算与判断,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,注意掌握溶质质量分数为概念及表达式,明确硫酸钠的浓度越大、密度越大,乙醇的浓度越大、密度越小为解答关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 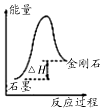 如图所示,从能量角度考虑,石墨比金刚石稳定 | |
| B. | 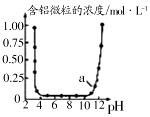 图表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+ | |
| C. | 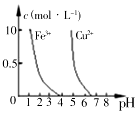 如图所示,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 | |
| D. | 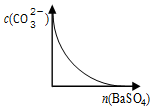 如图所示,在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.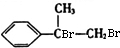 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$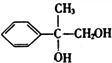 +2NaBr
+2NaBr 互为同分异构体
互为同分异构体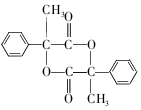 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.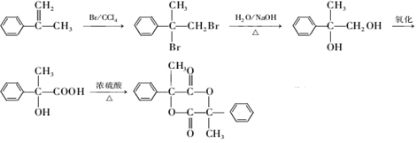 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
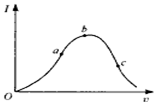 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
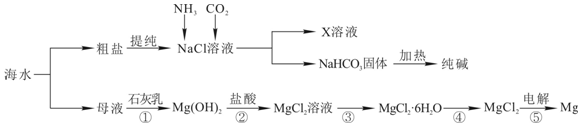
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +7 | B. | +2 | C. | +6 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| B. | 已知2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则石墨的燃烧热为 110.5 kJ•mol-1 | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量 | |
| D. | 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ•mol-1和1 411.0 kJ•mol-1,则乙烯水化制乙醇的热化学方程式为C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 | |
| C. | “84”消毒液主要成分为次氯酸钠,与适量白醋混合使用消毒效果会更好 | |
| D. | 夏季马路喷洒氯化钙溶液,氯化钙跟水分子结合形成结晶水合物起到保湿作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com