0.05mol某两种烃的混和物在足量O2中完全充分燃烧,产物依次通过足量浓硫酸和碱石灰,增重分别为2.7g和5.5g.则此混和物可能为( )
A.CH4C4H10
B.C2H2C4H10
C.C2H4C4H10
D.C2H6C3H6
【答案】
分析:烃完全燃烧生成二氧化碳和水,产物通过足量浓硫酸增重2.7g为水的质量,通过足量碱石灰增重5.5g为二氧化碳质量.
计算出水、二氧化碳的物质的量,根据H原子、C原子守恒,计算烃的平均分子组成,据此判断.
解答:解:烃完全燃烧生成二氧化碳和水,产物通过足量浓硫酸增重2.7g为水的质量,
所以水的物质的量为
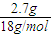
=0.15mol;
通过足量碱石灰增重5.5g为二氧化碳质量.
所以二氧化碳的物质的量为
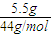
=0.125mol.
所以平均分子组成中碳原子数为:
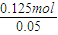
=2.5,氢原子数为
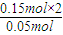
=6
即平均分子组成为C
2.5H
6.
A、若CH
4和C
4H
10,由碳原子可知为二者为1:1混合,其平均分子组成中H原子数目为7,由于平均分子组成中含有6个H原子,故A错误;
B、若C
2H
2和C
4H
10,由氢原子可知二者为1:1混合,其平均分子组成中C原子数目为3,由于平均分子组成中含有2.5个C原子,故B错误;
C、若C
2H
4和C
4H
10,由碳原子可知C
2H
4和C
4H
10按3:1混合,由氢原子可知C
2H
4和C
4H
10按2:1混合,混合比例不同,故不可能,故C错误;
D、若C
2H
6和C
3H
6,由氢原子可知按任意比混合,由碳原子可知为二者为1:1混合,故二者1:1混合,平均分子组成为
C
2.5H
6,故D正确.
故选:D.
点评:考查烃混合物分子式确定,难度较大,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

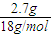 =0.15mol;
=0.15mol;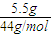 =0.125mol.
=0.125mol.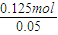 =2.5,氢原子数为
=2.5,氢原子数为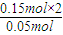 =6
=6

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案