
| A. | Si、P、S、Cl相应的最高价氧化物对应水化物的酸性依次增强 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 工业上通常用电解钠、铁、铜对应的氯化物制得该三种金属单质 | |
| D. | 钠与氧气反应的产物与反应条件无关 |
分析 A.同一周期元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.硅元素在自然界中以化合态存在;
C.Na采用电解熔融氯化钠的方法冶炼,Fe、Cu采用热还原法冶炼;
D.钠与氧气反应时,反应条件不同,反应产物不同.
解答 解:A.同一周期元素,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,Si、P、S、Cl的非金属性逐渐增强,所以其相应的最高价氧化物对应水化物的酸性依次增强,故A正确;
B.硅元素在自然界中只能以化合态存在,Si单质为半导体,纯净的硅晶体可用于制作计算机芯片,故B错误;
C.活泼金属采用电解其熔融盐或氧化物的方法冶炼,较不活泼金属采用热氧化还原法冶炼,所以Na采用电解熔融氯化钠的方法冶炼,Fe、Cu采用热还原法冶炼,故C错误;
D.钠与氧气在加热条件下反应生成过氧化钠,在空气中不加热氧化生成氧化钠,反应产物与反应条件有关,故D错误;
故选A.
点评 本题主要考查了元素化合物知识,侧重于考查学生的分析能力和综合运用化学知识的能力,注意硅的存在形式、注意一些金属的冶炼方法,平时应多注意积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,则NA个N2分子与足量氢气充分反应释放热量92.4kJ | |
| D. | Na2O2与CO2反应生成1 molO2时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M=WNA | B. | M=$\frac{16w}{b}$ | C. | M=$\frac{w}{16b}$ | D. | M=$\frac{w}{{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00ml0.1000mol•L-1(NH4)2SO4溶液中逐滴加入0.2000mol•L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A. | 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) | |
| C. | 点c所示溶液中:c(SO42-)+c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 点d所示溶液中:c(SO42-)>c(NH3•H2O)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol乙烯和乙醇(蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为4NA | |
| D. | 120gNaHSO4固体中含有的离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X溶液 | 固体Y |  |
| A | 浓硫酸 | 铜粉 | |
| B | 浓氨水 | CaO | |
| C | 稀盐酸 | 石灰石 | |
| D | 浓盐酸 | 高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
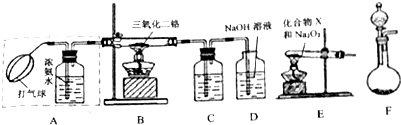
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A | 苯酚钠溶液中通入少量CO2 | 产生白色浑浊 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B | 在少量稀碳酸钠溶液中逐滴加入稀盐酸至过量. | 开始无气泡,后来有气泡. | CO32-+H+→HCO3- HCO3-+H+→CO2↑+H2O |
| C | 将过量氯化铝溶液逐滴加入到氢氧化钠溶液中 | 先产生白色沉淀而后逐渐溶解 | Al3++3OH-→Al(OH)3↓ Al(OH)3+OH-→AlO2-+H2O |
| D | 向含有酚酞的氢氧化钡溶液中滴加稀硫酸 | 产生白色沉淀,溶液由红色变成无色. | Ba2++OH+H++SO42-→BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com