
(共10分)甲醇合成反应及其能量变化如图所示:

(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
|
时间浓度(mol/L)温度 |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
|
300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
|
500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。该反应中a的大小对反应热ΔH有无影响,___________________________。
(每空2分,共10分)
(1)CO(g)+2H2(g)=CH3OH(g) ΔH=-(b-a) kJ·mol-1
(2)0.08 mol/(L·min)
(3)25
(4)80%
(5)无影响
【解析】(1)根据图像可知,反应物的总能量高于生成物的总能量,因此是放热反应,反应热ΔH=-(b-a) kJ·mol-1,所以热化学方程式是CO(g)+2H2(g)=CH3OH(g) ΔH=-(b-a) kJ·mol-1。
(2)10min时甲醇的浓度是0.4mol/,所以根据化学方程式可知,消耗氢气是0.8mol/L,则氢气的反应速率是0.8mol/L÷10min=0.08 mol/(L·min) 。
(3)在500 ℃达到平衡时,甲醇的物质的量浓度是0.8mol/L,所以消耗CO和氢气分别是0.8mol/L和1.6mol/L,则平衡时氢气和CO的浓度分别是0.4mol/L和0.2mol/L,则该温度下反应的平衡常数是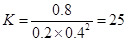 。
。
(4) CO(g)+2H2(g)=CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol) 1.2-x 2-2x x
则1.2-x+2-2x+x=3.2÷2
解得2x=1.6mol
所以氢气的转化率是2x÷2=0.8,即80%。
(5)反应热只与反应物和生成物能量的相对大小有关系,和其余条件都是无关系的。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013届山西省康杰中学等四校高三第一次联考化学试卷(带解析) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:
(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共8分)
水煤气法制甲醇工艺流程框图如下

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市崇明县高三高考模拟考试(二模)化学试卷(解析版) 题型:填空题
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: (甲醇)
(甲醇)  (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时 (CH3OH)
(CH3OH) ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH) ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com