
��9�֣�������������Ч���ٶ���������ŷš�ʵ�����÷�ú�ң���Ҫ�� �ȣ��Ʊ���ʽ������[Al2(SO4)x(OH)6-2x]��Һ����������������
�ȣ��Ʊ���ʽ������[Al2(SO4)x(OH)6-2x]��Һ����������������
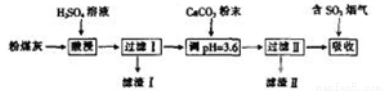
��1�� ����ܡ����ܡ�����NaOH��Һ����H2SO4��Һ��
��2�����ʱ��Ӧ�����ӷ���ʽΪ ��
��3����CaCO3������Һ��pH��3.6��Ŀ���� ��
��4����֪��ú����Al2O3����������Ϊ40.8%���Ƶõļ�ʽ������[Al2(SO4)x(OH)6-2x]��x=1.5��ijʵ��С��ȡ80.0g��ú�ҽ�������ʵ�飬�������������������������Ϊ10%������Ƶü�ʽ������������Ϊ ��
��1������
��2��Al2O3+6H+=2Al3++3H2O
(3)�к���Һ�е��ᲢʹAl2(SO4)3ת��ΪAl2(SO4)x(OH)6-2x��
��4��71.7
��������
���������(1)������NaOH��Һ����H2SO4��Һ����Ϊ��ú���е������������ᷴӦ���������費�����ᷴӦ�������������ƴ������ᣬ����߾������������Ʒ�Ӧ��������������ȡ��ʽ��������
��2�����ʱ�������������ᷴӦ������������ˮ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O��
��3������̼��Ƶ�Ŀ�����к��������ᣬͬʱʹAl2(SO4)3ת��ΪAl2(SO4)x(OH)6-2x��
��4��80.0g�ķ�ú������������������80.0g��40.8%=32.64g�����ʵ�����32.64g/102g/mol=0.32mol������AlԪ���غ㣬��Ϲ�����������ģ���֪�Ƶõļ�ʽ�����������ʵ�����0.32����1-10%��=0.288mol�������Ƶõļ�ʽ������[Al2(SO4)x(OH)6-2x]��x=1.5��������0.288mol��249g/mol=71.7g��
���㣺����Թ�ҵ���̵ķ��������ӷ���ʽ����д��Ԫ���غ㷨�ڼ����е�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�챱���и�����ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A����������������Һ�ķ�Ӧ�����û���Ӧ
B��4Fe(OH)2��O2��2H2O��4Fe(OH)3���ڻ��Ϸ�Ӧ
C��SO2+Cl2+2H2O��2HCl+H2SO4����������ԭ��Ӧ
D��AgNO3+HCl��AgCl��+HNO3�÷�Ӧ����˵���������Ա�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱���ж�������ͨУ����11��������ѧ�Ծ��������棩 ���ͣ������
��7�֣� �о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1���������������У������������������____________(�û�ѧʽ��ʾ)��
��2��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ �����÷�Ӧ6NO2��8NH  7N2��12 H2OҲ�ɴ���NO2����ת��1��2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2��12 H2OҲ�ɴ���NO2����ת��1��2mol����ʱ�����ĵ�NO2�ڱ�״������ L��
��3����֪��2SO2��g��+O2��g�� 2SO3��g�� ��H1= - 196��6 kJ��mol-1
2SO3��g�� ��H1= - 196��6 kJ��mol-1
2NO��g��+O2��g�� 2NO2��g�� ��H2= - 113��0 kJ��mol-1
2NO2��g�� ��H2= - 113��0 kJ��mol-1
��ӦNO2��g��+SO2��g�� SO3��g��+NO��g���� ��H3= kJ��mol-1��
SO3��g��+NO��g���� ��H3= kJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱��ʮ�и�����һѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2H2(g) +O2(g) �� 2H2O(g) ��H =��483.6 kJ/mol
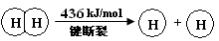

����˵������ȷ����
A��H2(g) �е�H��H ���� H2O(g) �е�H��O ���ι�
B��H2O(g)��H2(g) + 1/2O2(g) ��H = +241.8 kJ/mol
C���ƻ�1 mol H��O ����Ҫ��������463.4 kJ
D��H2(g) + 1/2O2(g)��H2O(l) ��H <��241.8 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱��ʮ�и�����һѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ�뻷�����������ϢϢ��أ�����˵���������
A��˫��ˮϡ��Һ��������ϴ�˿�
B��14C��������������ļ�����14C��12C��Ϊͬλ��
C��PM2.5����(��ֱ��ԼΪ2.5��10-6m)��ɢ�ڿ������γ����ܽ�
D������ˮ����ʹ��Cl2��FeSO4��7H2O�����������������Ը���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���и�����ѧ��9��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���������ᴦ������β�����õ���Σ���ͬ���εõ�a��b��c���ֲ�ͬ����Σ�����ȡ��ͬ��������Σ����뵽�̶�����NaOH��Һ�в����ȣ��ռ��������õ��������ɰ��������������ε����Ĺ�ϵͼ��
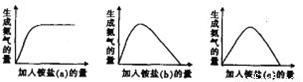
�����жϲ���ȷ���ǣ�
A��a��Ӧ�������(NH4)2SO4
B�� b��Ӧ�������(NH4)2SO4��NH4HSO4
C��c��Ӧ�������NH4HSO4
D����b��c��ε�������ͬʱ���ɵõ���ͬ�����İ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���и�����ѧ��9��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����ϩ����һ��ʳ���㾫����ṹ��ʽ��ͼ��ʾ�������й�����ϩ����˵����ȷ����
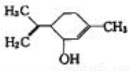
A����������������Һ�����кͷ�Ӧ
B���ܷ����ӳɷ�Ӧ��ȡ����Ӧ
C������ʹ���Ը��������Һ��ɫ
D����Ա������״�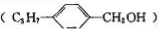 ��Ϊͬ���칹��
��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���������ظ�����ѧ������ͳһ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����һ���Լ������������ʣ�����CCl4��NaI��Һ��NaCl��Һ��Na2SO3��Һ�������Լ��в���ѡ�õ��� �� ��
A����ˮ B��FeCl3��Һ C������KMnO4 ��Һ D��AgNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹŸ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��ʵ��ࣩ��13�֣������£�ȡ0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��pH��6���Իش��������⣺
��1�������Һ����ˮ�������c (H+) 0.2 mol��L��1 HCl��Һ����ˮ�������c (H+) (�>��<��=��)��
��2������������������ʽ�ľ�ȷ����������������֣���
c (Cl��) ? c (M+)�� mol��L��1��c (H+) ? c (MOH) �� mol��L��1 ��
��3����������ȡ0.2 mol��L��1 MOH��Һ��0.1 mol��L��1 HCl��Һ�������ϣ���û����Һ��pH��7��˵��MOH�ĵ���̶� (�>��<��=��)MCl��ˮ��̶ȡ���Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
��4����������pH��3��������pH��11�İ�ˮ��Һ�������ϣ�������Һ��pH��7���>��<��=������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com