
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
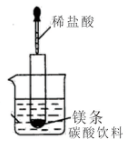 (1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.
(1)如图所示(夹持仪器省去),把试管放入盛有20℃碳酸饮料的烧杯中,试管中开始放入几块镁条,再用滴管滴加5ml的盐酸于试管中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
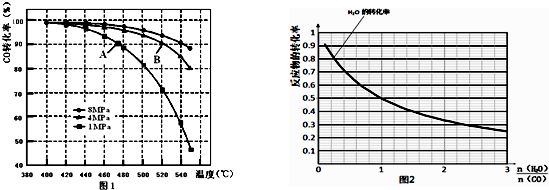
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
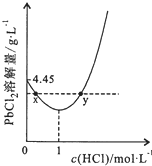 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
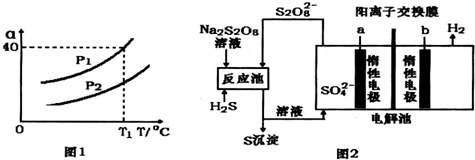
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
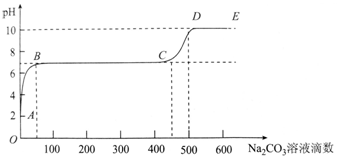
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com