
已知Cu(IO3)2与KI在酸性条件下可发生氧化还原反应,反应的离子方程式如下:
IO3―+I―+H+ ― I2+H2O 2Cu2++4I―=2CuI↓+H2
请回答下列问题:
(1)为下列离子方程式配平(系数为1也要填上)
IO3―+ I―+ H+ ― I2+ H2O
(2)室温下,向100mL Cu(IO3)2溶液中加入足量的酸化的KI溶液,反应完毕后,再用0.1mol/L的Na2S2O3溶液滴定(I2+2S2O32―=2I―+S4O62―),消耗了39mL的Na2S2O3溶液,则滴定时,所用的指示剂可以是 ,原饱和溶液中Cu(IO3)2的物质的量浓度为 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液中某些具有一定氧化性的离子的浓度的测定方法是:取一定体积的溶液,先向其中加入足量的经酸化的KI溶液,I-在酸性条件下被氧化成I2,然后用已知浓度的Na2S2O3溶液进行滴定,发生反应:I2+2![]() ====2I-+
====2I-+![]() 来测定I2的量,从而可以求出氧化性离子的浓度。
来测定I2的量,从而可以求出氧化性离子的浓度。
(1)以上滴定操作需要加入__________(从选项中选择)作为指示剂来判断滴定终点,滴定终点的现象是__________。
A.酚酞溶液
B.KMnO4酸性溶液
C.淀粉溶液
D.甲基橙溶液
(2)已知Cu2+可以与I-发生反应:2Cu2+4I-====2CuI+I2,若取20.00 mL某CuCl2溶液进行上述操作,最后消耗0.11 mol·L-1的Na2S2O3溶液20.00 mL,则CuCl2溶液的物质的量浓度为__________mol·L-1。
(3)![]() 也可以与I-发生如下反应:5I-+
也可以与I-发生如下反应:5I-+![]() +6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。
+6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
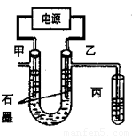
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色??? B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH) 2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH) 2的Ksp=2.2×10-20)。
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-。该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
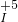 被氧化
被氧化查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com