
天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=
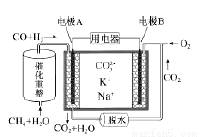
(3)用甲烷?空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:

①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南师大附中高一实验班下期末理综化学卷(解析版) 题型:选择题
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O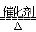 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+ 2OH—-2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
下列关于化学平衡的说法中,正确的是( )
A.当达到化学平衡时,各物质的浓度就不再变化了
B.当达到化学平衡时,反应物已完全转化为生成物
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时.正逆反应均已停止
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
第三周期元素中,与氢气反应生成的气态氢化物最稳定的是( )
A. 钠 B. 硅 C. 硫 D. 氯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M4均为直线形的共价化合物
C. W2Z2是既含离子键又含共价键的离子化合物
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是
|
| Y |
| X |
|
Z |
|
|
A.Y与Z的原子序数之和可能为2a
B.Y的原子序数可能为a-17
C.Z的原子序数可能为a+31
D.X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:简答题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为______________(填元素符号)。
②SO42-的空间构型为________,与SO42-互为等电子体的有机分子的化学式为_________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________;在该晶体中存在的化学键的种类有_____________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。

(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,求算阿伏加德罗常数的表达式为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津一中高一下期末化学试卷(解析版) 题型:简答题
VIA 元素的各种性质可归纳整理如下:
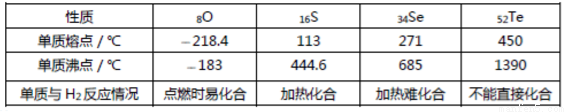
回答下列问题:
(1)碲(Te)的氧化物分子式是____________________。
(2)硒酸与碲酸酸性较强的是____________________(填化学式)。
(3)比较键能:H—S H—Se(填“>”或“<”)。
(4)氢硒酸放在空气中,可能发生反应的化学方程式为______________________________。
(5)下图所示为 VIA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示VIA 族中某一元素的单质,下图为相同物质的量的单质与 H2反应过程中的体系温度变化。
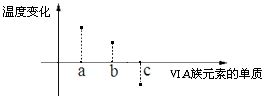
则:c 代表__________。(均写单质名称)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com