
��10�֣�ÿ��2�֣�A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ������������������A��DԪ��ͬ������A��ԭ�Ӱ뾶��С��Ԫ�أ�B��CԪ��ͬ����,B�������������Ǵ�����������2������A��B��C��D�е�����Ԫ�ؿ��γ�ԭ�Ӹ�����Ϊ1:1�Ķ��ֻ�����ס��ҡ���Ϊ���е����֣����ǵ�Ԫ��������±���ʾ��
������ | �� | �� | �� |
���Ԫ�� | B��C | A��C | C��D |
�����£�������Ϊ���壬�ܶ���С�ڿ�����������ΪҺ�壻������Ϊ������Ϊ���ӻ��������д���пհף�
��1���ҵĻ�ѧʽΪ �������ʵĻ�ѧʽΪ �����б����������������ӵĸ���֮��Ϊ ��
��2��ijͬѧ�����һ��CH3OHȼ�ϵ�أ����øõ�ص��200mLһ��Ũ�ȵ�NaCl��CuSO4�Ļ����Һ����װ������ͼ��

��д������ͨ��״���һ���ĵ缫��Ӧʽ ��
�������Ϣ���������������������ʱ��仯�Ĺ�ϵ������ͼ��ʾ����������ѻ���ɱ�״���µ��������д����t1��ʯī�缫�ϵĵ缫��Ӧʽ ��
��10�֣�ÿ��2�֣�
��1��H2O2 Na2O2 1:2
��2���� CH3OH �� 6e��+ 8OH�� = CO32��+ 6H2O
�� 4OH�� �� 4e�� = O2��+ 2H2O
(��2 H2O �� 4e�� = O2��+4 H+��
��������
���������A��ԭ�Ӱ뾶��С������A��HԪ�أ�B�������������Ǵ�����������2������B�Ĵ���������ֻ����2��������������4������B�ǵڶ�����Ԫ��CԪ�أ�D��Aͬ���壬��D��NaԪ�أ�C��N��O��F����Ԫ���е�һ�֣�B��C�γ����ʼף������£�������Ϊ���壬�ܶ���С�ڿ�������C��OԪ�أ���C�γɵ�CO���ܶȱȿ�����С������H��O�γɵ�ԭ�Ӹ�������1:1��Һ̬����������ǹ������⣻����O��Na�γɵ�1:1�����ӻ�������Ա��ǹ������ơ�
��1���ҵĻ�ѧʽ��H2O2�����Ļ�ѧʽ��Na2O2�����е��������������ӣ���������O22-���������������ӵĸ���֮��Ϊ1:2��
��2���٢���ͨ��״���һ������������Ӧ���״�ʧȥ���������������ӽ��Ϊ̼������Ӻ�ˮ���缫��Ӧʽ��CH3OH �� 6e��+ 8OH�� = CO32��+ 6H2O��
��ͨ��������һ������������ʯīΪ����������������Ӧ������ͼ���֪��t1ǰ�������ӷŵ�����������t1�������������ӷŵ���������������ʯī�缫��t1�����ĵ缫��Ӧʽ��4OH�� �� 4e�� = O2��+ 2H2O (��2 H2O �� 4e�� = O2��+4 H+����
���㣺����Ԫ�ص��ƶϣ��绯ѧ��Ӧԭ����Ӧ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��ȷ����
A��HCO3����ˮ�ⷽ��ʽΪ��HCO3����H2O H2CO3��OH��
H2CO3��OH��
B������ȼ�ϵ�صĸ�����Ӧʽ��O2 + 2H2O + 4e����4OH��
C����ͭ���缫���NaCl��Һ��2Cl����2H2O Cl2����H2����2OH��
Cl2����H2����2OH��
D���ö��Ե缫���CuCl2��Һ��2Cu2����2H2O 4H����O2����2Cu
4H����O2����2Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��Ǩ�и߶���ѧ��ѧҵˮƽģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����װ����ʾ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���

A����װ��A����������������� B����װ��B�ռ�NO����
C����װ�DC��ʵ��������ȡ���� D����װ��D��ȥCl2�е�HC1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ��������У����3�����Ͽ������ۻ�ѧ�Ծ��������棩 ���ͣ������
(16��)������������(Na2S2O4)���ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�飺
I�����������ϡ�
��1��������������(Na2S2O4)��һ�ְ�ɫ��ĩ��������ˮ���������Ҵ���
��2��2Na2S2O4��4HCl= 4NaCl��S����3SO2����2H2O��Na2S2O3��2HCl= 2NaCl��S����SO2����H2O��
II�����Ʊ�������
75��ʱ�������ƺʹ�������Ҵ�ˮ��Һ�У�ͨ��SO2���з�Ӧ������䷴Ӧ����ʽ��

��ȴ��40��50�棬���ˣ��� ϴ�ӣ������Ƶ�Na2S2O4��
III����Na2S2O4�����ʡ�
��1��Na2S2O4��Һ�ڿ������ױ�����������С��ⶨ0.050mol/L
Na2S2O4��Һ�ڿ�����pH�仯��ͼ��ʾ��0��t1����Ҫ������HSO3��������pH�仯ͼ��HSO3���ĵ���̶� ˮ��̶�(���������)��

����С���Ʋ�Na2S2O4��Һ�ڿ������ױ�������0��t1�η������ӷ�Ӧ����ʽΪ ��t3ʱ��Һ����Ҫ�����ӷ����� ��
��2��������������Na2S2O4������ȫ�ֽ⣬�õ��������Na2SO3��Na2S2O3������Ϊ (�ѧʽ)��
�������ʵ����֤������Na2S2O3���ڣ�����±������ݡ�
(��ѡ����Լ���ϡ���ᡢϡ���ᡢBaCl2��Һ��KMnO4��Һ)
ʵ�鲽��(��Ҫ��д�������������) | Ԥ�ڵ�ʵ������ͽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ��������У����3�����Ͽ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
H2��I2��һ���������ܷ�����Ӧ��H2(g)��I2(g)  2HI(g) ��H����a kJ/mol����֪��
2HI(g) ��H����a kJ/mol����֪��
 (a��b��c��������)��
(a��b��c��������)��
����˵����ȷ����
A��H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ�
B���Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ(c��b��a) kJ
C����ͬ�����£�1 mol H2 (g)��1mol I2 (g)������С��2 mol HI (g)��������
D�����ܱ������м���2 mol H2 (g)��2 mol I2 (g)����ַ�Ӧ��ų�������Ϊ2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и�����ѧ����ĩ���Ի�ѧB�Ծ��������棩 ���ͣ�ѡ����
������ʵһ����˵��HF���������
�ٳ�����NaF��Һ��pH����7 ����HF��Һ��������ʵ�飬���ݺܰ�
��HF��NaCl���ܷ�����Ӧ �ܳ�����0.1mol/L��HF��Һ��pHΪ2.3
��HF����Na2CO3��Һ��Ӧ������CO2���� ��HF��ˮ��������Ȼ���
��1mol/L��HFˮ��Һ��ʹ��ɫʯ����Һ���
A���٢ڢ� B���ڢۢ� C���ۢܢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и�����ѧ����ĩ���Ի�ѧB�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾʵ��װ����ɶ�Ӧ��ʵ�飨����������ʡ�ԣ����ܴﵽʵ��Ŀ����
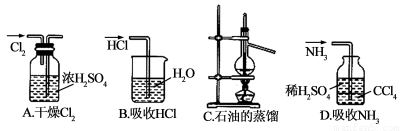
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���2����ĩͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
A��B��C��D��E���ֶ�����Ԫ��ԭ��������������Aԭ��Ϊ�뾶��С��ԭ�ӣ�Cԭ��������������A��Bԭ������������֮����ȣ�Dԭ�Ӻ�Bԭ�������������ĺ�ΪCԭ��������������2����Dԭ�ӵ�����������Ϊ���Ӳ�����3����A��Eͬһ���塣����˵����ȷ��
A��ԭ�Ӱ뾶��С˳��Ϊ��E>D>C>B>A
B��A��B��C��D����Ԫ�ض����ڷǽ���Ԫ�أ�����֮��ֻ���γɹ��ۻ�����
C��B��D����Ԫ����AԪ���γɵ��������ķе���������
D��D��A��E�����γɾ���ǿ�����ԵĻ���������ڳ�������ˮ��ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����ʮУ������ѧ��3��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ���������ֵ������˵���������

A��һ�������£�2molSO2��1molO2������ܱ������г�ַ�Ӧ�������еķ���������2NA
B��256g S8�����к�S-S��Ϊ7NA��
C����1molCH3COONa������CH3COOH�γɵ�������Һ�У�CH3COO����ĿΪNA��
D��1 mol Na��O2��ȫ��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶ�������ΪNA��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com