
Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ1��2��ʾ��ʵ�顣��ش�������⡣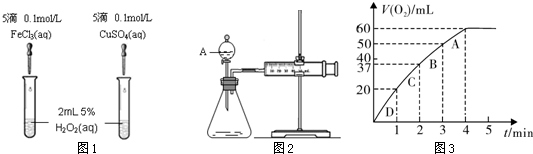
��1�����Է�������ͼ1��ͨ���۲� �����ԱȽϵó����ۡ���ͬѧ�����FeCl3��Ϊ0.05 mol/L Fe2(SO4)3��Ϊ�������������� ��
��2��������������ͼ2��ʾ��ʵ��ʱ������40 mL���壬��������Ӱ��ʵ������ؾ��Ѻ��ԡ�ʵ������Ҫ������������ ��
��3������0.10 mol MnO2��ĩ��50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ3��ʾ��
��д��H2O2�ڶ������������·�����Ӧ�Ļ�ѧ����ʽ ��
��ʵ��ʱ�ų������������� mL��
��A��B��C��D���㷴Ӧ���ʿ�����˳��Ϊ�� �� �� �� ��
���ͷ�Ӧ���ʱ仯��ԭ�� ��
��H2O2�ij�ʼ���ʵ���Ũ���� ���뱣����λ��Ч���֣���
��1���������ݵĿ�����1�֣������������Ӳ�ͬ��ʵ��ĸ��ţ�1�֣�
��2������40 mL���������ʱ�䣨1�֣�
��3����2H2O2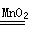 2H2O+O2����1�֣� ��60��1�֣�
2H2O+O2����1�֣� ��60��1�֣�
��D C B A��1�֣������ŷ�Ӧ�Ľ��У�H2O2Ũ�ȼ�С����Ӧ���ʼ�����1�֣�
��0.11 mol/L��1�֣�
��������������Ÿ÷�Ӧ�в������壬���Կɸ����������ݵĿ����жϣ��Ȼ���������ͭ���������Ӷ���ͬ�����ж��������������û��������������ã������ƺ�����ͭ��������ͬ���������������Ӳ�ͬ��ʵ��ĸ��ţ���Ϊ����֧�Թ��в������ݵĿ��������������Ӳ�ͬ��ʵ��ĸ��ţ�
���������Ʒ�Һ©������������Եķ������رշ�Һ©���Ļ�������ע����������������һ�Σ���һ������Ƿ�ص�ԭλ���÷�Ӧ��ͨ����������ķ�Ӧ���ʷ����жϵģ����Ը���v= ֪����Ҫ�����������Dz���40ml��������Ҫ��ʱ�䣬��Ϊ����Һ©�����رշ�Һ©���Ļ�������ע����������������һ�Σ���һ������Ƿ�ص�ԭλ������40ml��������Ҫ��ʱ�䡣
֪����Ҫ�����������Dz���40ml��������Ҫ��ʱ�䣬��Ϊ����Һ©�����رշ�Һ©���Ļ�������ע����������������һ�Σ���һ������Ƿ�ص�ԭλ������40ml��������Ҫ��ʱ�䡣
�Ǵ����ߵ�б�ʿ���֪����Ӧ����Խ��ԽС����Ϊ��Ӧ�����뷴Ӧ��Ũ�ȳ����ȣ����ŷ�Ӧ�Ľ��У���Ӧ��Ũ�����ͣ���Ӧ������С��
�����ڶ������������������£�˫��ˮ�ֽ�����ˮ����������Ӧ����ʽΪ��2H2O2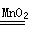 2H2O+O2����
2H2O+O2����
�ڸ���ͼ��֪����4����ʱ������ʱ������ƣ�����������䣬����ʵ��ʱ�ų�������������60 mL��
�۸���ͼ����v= ֪��A��B��C��D���㷴Ӧ���ʿ�����˳��ΪD��C��B��A��
֪��A��B��C��D���㷴Ӧ���ʿ�����˳��ΪD��C��B��A��
��Ӧ�����뷴Ӧ��Ũ�ȳ����ȣ����ŷ�Ӧ�Ľ��У���Ӧ��Ũ�����ͣ���Ӧ������С��
����˫��ˮ�����ʵ���Ϊx��
2H2O2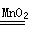 2H2O+O2��
2H2O+O2��
2mol 22.4L
x 0.06L
x= =0.0054mol��
=0.0054mol��
���������ʵ���Ũ��=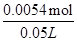 ="0.11" mol��L-1���ʴ�Ϊ��0.11 mol��L-1��
="0.11" mol��L-1���ʴ�Ϊ��0.11 mol��L-1��
���㣺����̽����ѧ���ɣ�����ʵ�鷽������ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��8�֣�ij�¶�ʱ����0.5L�ܱ�������ijһ��Ӧ��A��B�������ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ�����ã�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
��2����Ӧ��ʼ��4minʱ��B��ƽ����Ӧ����Ϊ____________��
��3��ƽ��ʱA��ת����Ϊ________����4minʱ�����淴Ӧ���ʵĴ�С��ϵΪ����(��)___��(��)�����������������������ͬ������8minʱ����(��)___��(��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��12�֣������ҹ�Ŀǰ����ҵ��չ�ٶ�,Ԥ��2020����������������2����,�й��ѳ�Ϊȫ�����������г�����ˣ������Ч���������ŷŵ�β��������Ҫ�����о���һ����Ҫ���⡣Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�
2NO��2CO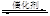 2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ��ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�졣
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�顣
��1���������ʵ����Ʊ������в�Ҫ���ո�
| ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ���� m2/g |
| �� | Ϊ����ʵ�������� | 280 | 6.50��10-3 | 4.00��10-3 | 80 |
| �� | | | | | 120 |
| �� | ̽���¶ȶ�β��ת�����ʵ�Ӱ�� | 360 | | | 80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��18�֣�����ڹ�ũҵ������������Ҫ����;�������Ҫ��������и��⡣
��.ij��ѧ��ȤС����������װ����ѡȡ��Ҫ��װ����ȡ(NH4)2SO4��Һ��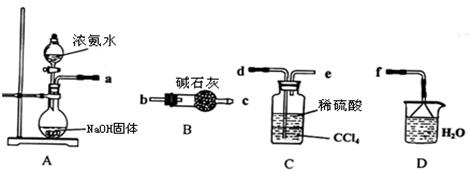
��1���������ӵ�˳���ýӿ������ĸ��ʾ���ǣ�a
��2���Դӵ���ƽ��Ƕȷ�����ʵ��װ��A���ܲ���������ԭ��
��
��3����װ��C������Һ����뿪�IJ��������� ��
��4��(NH4)2SO4���Ͷ����д̼��ԣ�����ʪ�ԡ���ʪ��̽�ɿ顱������Ӧע�� ��
��.Ϊ����Ȼ�淋ľ��ü�ֵ���ҹ���ѧ�����������������þ�ȷֽ��Ȼ���ư������õ���ʽ�Ȼ�þ[Mg(OH)Cl]�Ĺ��ա�ijͬѧ���ݸ�ԭ����Ƶ�ʵ��װ����ͼ��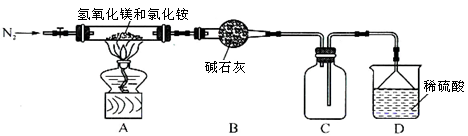
��ش��������⣺
��1��װ��A�з�����Ӧ���ɼ�ʽ�Ȼ�þ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�����г���ͨ��N2�����������㣺һ��ʹ��Ӧ�����İ�����ȫ��������ϡ���������գ�
���� ��
��3����MgCl2��Һ�����õ�MgCl2��6H2O���壬������Ŀ����_________��
a���õ��ȱ�����Һ b����������
��4��þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ��������ǣ�
��
����MgCl2��6H2O�Ʊ���ˮMgCl2�IJ����� ��Χ�н��У����ڿ����м��ȣ��������Mg(OH)Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
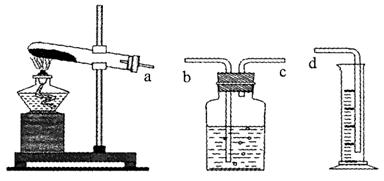
ijͬѧ��MnO2��CuO��Fe2O3��Cr2O3����������ȷֽⷴӦ�еĴ����ý������о���ʵ�������������±����ͱ�ʵ����й����⣬����գ�
| ʵ���� | KClO3��g�� | ������ | �������壨mL����������Ϊ����� | ��ʱ��s�� | ||
| ��ѧʽ | ������g�� | ʵ�ʻ��� | ||||
| 1 | 0.6 | �� | �� | �� | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | �쳣 | 67.2 | 188.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
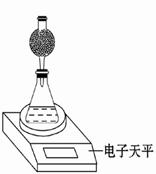
ij̽��С���ò���HNO3�����ʯ��Ӧ�������������̼�ݳ�������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء���ѡ�Լ�����ʵ������в�����ϡ����Ļӷ���
1.0mol��L��1 HNO3��2.0mol��L��1 HNO3��ϸ��������ʯ���ֿ�������ʯ��35 ��ˮԡ
(1)������ܽ��е�̽�����ݣ���д����ʵ����Ʊ������̽��ʵ�飺
| ʵ���� | T/�� | ����ʯ��� | HNO3Ũ��/mol��L��1 |
| �� | ���� | �ֿ�������ʯ | |
| �� | ���� | �ֿ�������ʯ | 2.0 |
| �� | | �ֿ�������ʯ | 2.0 |
| �� | ���� | | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�±���ϡ������ij������Ӧ��ʵ�����ݣ�
| ʵ����� | ��������/g | ����״̬ | c(H2SO4) /mol��L��1 | V(H2SO4) /mL | ��Һ�¶�/�� | ������ʧ��ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | ��״ | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | ��״ | 1.0 | 50 | 20 | 35 | 125 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com