
����Ŀ��X�Ǻϳ�̼���������һ����Ч��������ԭ������������EDTA��Fe3+��Ӧ�õ���

��1��EDTA��̼ԭ���ӻ��������Ϊ_________________��EDTA������Ԫ�صĵ縺����С�����˳��Ϊ__________________��
��2��Fe3+��̬��������Ų�ʽΪ_________________��
��3��EDTA������ʮһ�����Է��������dz��ӽ�����EDTA�ķе㣨540.6 �棩������ʮһ��ķе㣨100 �棩�ߵ�ԭ����_________��
��4��1 mol EDTA�к��ЦҼ�����ĿΪ______________��
��5��X�е���λԭ����___________��
���𰸡�sp2��sp3 H < C < N < O [Ar]3d5��1s22s22p63s23p63d5 EDTA���Ӽ������� 35 mol N��O
��������
��1��EDTA���Ȼ���Cԭ�Ӽ۲���ӶԸ�����3���Ǽ���Cԭ�Ӽ۲���ӶԸ�����4�����ݼ۲���ӶԻ��������ж�Cԭ���ӻ�������ͣ�Ԫ�صķǽ�����Խǿ����縺��Խ��
��2��Feԭ��ʧȥ3���������������ӣ����ݹ���ԭ����д�����Ӻ�������Ų�ʽ��
��3�����γɷ��Ӽ�����������۷е�ϸߣ�
��4�����۵���Ϊ����������˫���к���һ��������һ����������1��EDTA��������������Ŀ35��
��5��X��N��Oԭ���ṩ�µ��Ӷԡ�
(1)EDTA���Ȼ���Cԭ�Ӽ۲���ӶԸ�����3���Ǽ���Cԭ�Ӽ۲���ӶԸ�����4,���ݼ۲���ӶԻ��������ж�Cԭ���ӻ��������,ǰ��Ϊsp2�ӻ�������Ϊsp3�ӻ���Ԫ�صķǽ�����Խǿ����縺��Խ�ǽ�����H<C<N<O����縺��H<C<N<O��
�ʴ�Ϊ��sp2��sp3��H<C<N<O��
(2)Feԭ��ʧȥ3����������������,���ݹ���ԭ����д�����Ӻ�������Ų�ʽΪ[Ar]3d5��1s22s22p63s23p63d5��
�ʴ�Ϊ��[Ar]3d5��1s22s22p63s23p63d5��
(3)���γɷ��Ӽ�����������۷е�ϸߣ�EDTA���γɷ��Ӽ�������������۷е�ϸߣ�
�ʴ�Ϊ��EDTA���Ӽ���������
(4)���۵���Ϊ����������˫���к���һ��������һ����������1��EDTA��������������Ŀ35������1molEDTA�к�����������ĿΪ35mol��
�ʴ�Ϊ��35mol��
(5)X��N��Oԭ���ṩ�µ��Ӷԣ�����N��OΪ��λԭ�ӣ�
�ʴ�Ϊ��N��O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������軯�أ�K4[Fe(CN)6])˫�ƻ�Ѫ�Σ���һ����Ҫ�Ļ���ԭ�ϡ����������������ķ�ӦΪ��K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]��(������) +3KCl���ش����⣺
(1)д����̬Fe3+�ĺ�������Ų�ʽ_________��
(2)K4[Fe(CN)6]�е������������ۼ��⣬����______��________������12mol ������K4[Fe(CN)6�����ʵ���Ϊ________mol��
(3)��Ѫ����Nԭ�ӵ��ӻ���ʽΪ______��C��N��O�ĵ�һ�������ɴ�С������Ϊ_____���縺���ɴ�С������Ϊ________��
(4)Fe��Na��K�ľ���ṹ��ͼ��ʾ��
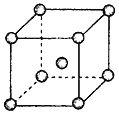
�� �Ƶ��۵�ȼظ��ߣ�ԭ����__________________________��
�� Feԭ�Ӱ뾶��r cm�������ӵ�����ΪNA���������ԭ������Ϊa���������ʵ��ܶ���_______g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1 mol CO2��0.3 mol C�ں�ѹ�ܱ������з�����Ӧ��CO2(g) + C(s)2CO(g)��ƽ��ʱ����ϵ�и����������������¶ȵĹ�ϵ��ͼ����֪���������ѹ��ʾ�Ļ�ѧƽ�ⳣ��KP = ![]() �������ѹ(P��) = ������ѹ(P��) ���������������˵����ȷ����
�������ѹ(P��) = ������ѹ(P��) ���������������˵����ȷ����
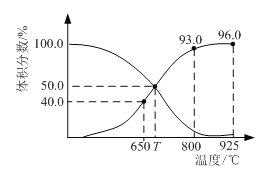
A.650��ʱ��CO2��ƽ��ת����Ϊ25%
B.800����ƽ��ʱ������������He��v�� < v��
C.T ����ƽ��ʱ��������������CO2��COʱ��v�� > v��
D.925��ʱ����ƽ�������ѹ��ʾ�Ļ�ѧƽ�ⳣ��KP = 23.04P��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ӦH2SO4�ȱ��������ԣ��ֱ��ֳ����Ե���
A.Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O
CuSO4+SO2��+2H2O
B.Zn+ H2SO4==ZnSO4+H2��
C.C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
D.CuO+ H2SO4=CuSO4 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��Ʋ�������Fe3O4����ģ��������ˮ����Ԫ�ص���Ҫʵ���������£�

��֪����CaO2��������Һ�е�FeCl2����Ӧ����Fe(OH)3��Fe3����
�ڲ��ӵ�Ca2��Ƕ��Fe3O4�У�ϴ��ʱ����ʧ������ʱ���γ�Ca3(PO4)2�ȳ�����
����Һ��pH���������������������Ӱ�졣pHԽ�ߣ��������������Խ�ࣻ pHԽ�ͣ��������������Խ�ࡣ
��1����FeCl2��FeCl3�����Һ�еμ�NaOH��Һ��һ�������·�Ӧ����Fe3O4�������ӷ���ʽΪ___________��
��2����������pH��11������������70�������½��У����˵ļ��ȷ�ʽΪ________��Ϊ��߹�����Ч�������ɲ�ȡ�Ĵ�ʩΪ_______________��
��3����Ԫ�ص�����Ч����H3PO4ˮ��Һ�к������ֲַ�������pH�Ĺ�ϵ�ֱ���ͼ1��ͼ2��ʾ��

�ٲ������KH2PO4��Һģ���ˮ���������������(pH > 2)����Ԫ���������ϴ�ԭ���ǣ�pHԽ�ͣ��������������������Խ�࣬���������������ӣ�___________________
�ڲ������������ȡ�����ü�Һ���������ס���ϱ������ݣ������Ʋ�������Fe3O4������������������������ȵ������У�________��
��ͬ���������������������������Ƚ�
������ | ����Ʒ | ��Fe3O4 | �մɲ��� |
������/mg��g��1 | 24.1 | 5.0 | 12.5 |
��4������ƴӲ����Ӧ���������ƿ�л�ȡ�Ʋ�������Fe3O4��Ʒ��ʵ�鷽�����ô��������������Һ���룬______________����ɸ��ɸ�ֵõ���Ʒ (ʵ������ʹ�����Լ��������У�����ˮ����ˮ�Ҵ���pH�ơ��в�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������к��е���������(�����е�����)�ķ����д�����ǣ� ��
A.H2(HCl)��ͨ��ˮϴ���ٸ���
B.NO��NO2)��ͨ��ˮϴ���ٸ���
C.Na2CO3���壨NaHCO3�������Ȼ����
D.Fe2+��Һ��Fe3+��������CuƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������־��壬���������з�ʽ��ͼ��ʾ�����л�ѧʽ��ȷ���ǣ� ��
A. AB2 ![]()
B. EF2 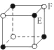
C. XY3Z 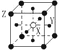
D. AB3 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����2RCHO+O2![]() 2RCOOH������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ1��ʾ��
2RCOOH������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ1��ʾ��
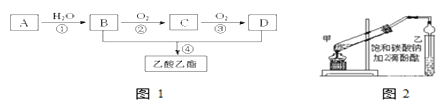
(1)B��D�����ں��еĹ����ŷֱ���____��______(������)��
(2)д�����з�Ӧ�ķ�Ӧ���ͣ���______����________��
(3)B��C�ķ�Ӧ����ʽΪ____________
(4)������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ������ȡ����Ҫ�������£�
���ڼ��Թ�(��ͼ2)�м���2mLŨ���ᡢ3mL�Ҵ���2mL����Ļ����Һ��
�ڰ���ͼ���Ӻ�װ��(װ������������)��������Һ����С����ȵؼ���3��5min��
�۴��Թ����ռ���һ���������ֹͣ���ȣ������Թܲ�������Ȼ���ô��ֲ㡣
�ܷ�����л��㡢ϴ�ӡ����
a.��ʵ����������ͺ�18O���Ҵ����ã��÷�Ӧ�Ļ�ѧ����ʽ�ǣ�______����װ���в��������θ���ܣ���������_________��
b���������Թ��е����ʷ��뿪�Եõ���������������ʹ�õ�������_____������ʱ����������Ӧ�ô�����____(����¿ڷ��� �����Ͽڵ���)����
c���������������ķ�Ӧ�ǿ��淴Ӧ����Ӧһ��ʱ�������������˵���Ҵ��������������Ӧ�Ѵﵽ��ѧƽ��״̬����(�����)______��
�ٻ�����и����ʵ�Ũ�Ȳ��ٱ仯��
�ڵ�λʱ�������1mol�Ҵ���ͬʱ����1mol���
�۵�λʱ�������1mol����������ͬʱ����1mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�ں�ˮ�������ۺ����÷��棬�����λ��ȫ��ǰ�С��Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��
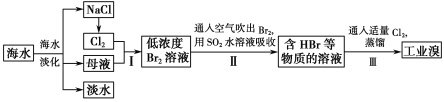
��1�����оٺ�ˮ���������ַ�����___��___��
��2����NaCl��Һ���е�⣬�ڵ����п�ֱ�ӵõ��IJ�Ʒ��H2��___��___��
��3����������ѻ��Br2����������ֽ�Br2��ԭΪBr-����Ŀ����___��
��4���������SO2ˮ��Һ����Br2�������ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com