
| A. | CH4+Cl2-→CH3Cl+HCI | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | nCH2═CH2-→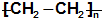 | |
| D. | CH3CH2OH+CH3COOH-→CH3COOCH2CH3+H2O |
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

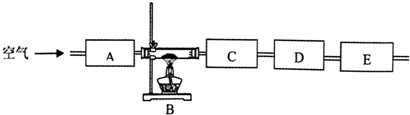
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
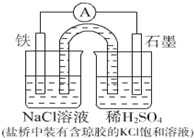
| A. | Fe作正极,发生氧化反应 | |
| B. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| C. | 正极反应:2H++2e-=H2↑ | |
| D. | 工作一段时间后,NaCl溶液中c(Na+ )增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KI+Br2═2KBr+I2 | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | SO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$H2SO4 | D. | MgCl2+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
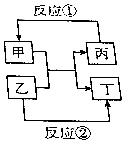 物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:
物质甲、乙、丙、丁的相互转化关系如图所反应所示(部分反应物、产物及反应条件已略去),已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物.回答下列间题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
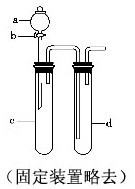 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com