
I.甲醇是一种可再生燃料,它的沸点为64.7oC。有科学家提出:把含有过量CO2的空气吹入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:
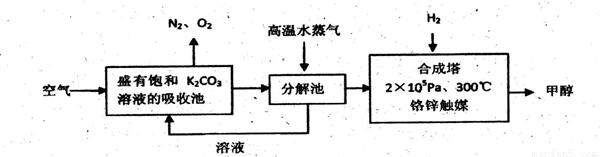
试回答下列问题:
(1)写出吸收池中主要反应的化学方程式 。
(2)在2×105pa、300℃合成塔中,若有440gCO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
。
Ⅱ.二氧化氯(C1O2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备C1O2的反应原理常采用:2NaC1O3+4HC1=2C1O2↑+C12↑+2H2O+2NaC1。若反应中产生0.1mo1C1O2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取C1O2的新工艺。
①下图示意用石墨做电极,在一定条件下 电解饱和食盐水制取C1O2。写出阳极产生C1O2的电极反应式:____。
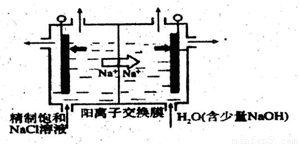
②电解一段时间.当阴极产生的气体体积为112mL(标准状况)时,停止电解。
通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)C1O2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-,现用C1O2将CN-氧化,产物中有两种为气体,其离子反应方程式为 。
I.(1)K2CO3+CO2+H2O=2KHCO3 (2)CO2(g)+3H2(g)→CH3OH(l)+H2O(l)ΔH=-49.5kJ/mol;
(3)CH3OH+8OH--6e-=CO32-+6H2O
Ⅱ.(1)0.1 (2)①Cl-+2H2O-5e-=ClO2↑+4H+ ②0.01 在阴极发生2H2O+2e-=H2↑+2OH-,氢离子浓度减小,使水的电离平衡向右移动,氢氧根离子浓度增大,pH值增大。(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl-
【解析】
试题分析:I.(1)反应物为二氧化碳和碳酸钾溶液,不难想到产物是碳酸氢钾;根据反应物和产物不难写出相关化学方程式。(2)先写出化学方程式,标注出物质聚集的状态:CO2(g)+3H2(g)→CH3OH(l)+H2O(l);10molCO2放出热量495kJ热量,1molCO2放出热量49.5kJ热量,不难写出相关化学方程式。
(3)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,碱性电解质溶液中电极反应为:CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O。
Ⅱ.(1)根据所给的化学方程式,我们可得到每生成2molClO2,转移2mol电子,所以反应中产生
0.1mo1C1O2,则转移电子的物质的量为0.1mol。(2)①阳离子钠离子移向右边,右边为阴极,左边为
阳极,反应物为Cl-,产物为ClO2;不难写出阳极电极方程式:Cl-+2H2O-5e-=ClO2+4H+。 ②阴极能够
获得电子的必然为水中的氢离子,阴极电极方程式:2H2O+2e-=H2↑+2OH-;当阴极产生的氢气体积为
112mL(标准状况)时,即0.005molH2,转移0.01mol电子,当然通过阳离子交换膜的阳离子的物质的
量为0.01mol;(3)根据反应物和产物不难写出相关的离子方程式。
考点:考查热化学方程式书写,燃料电池电极反应书写,题目综合性强,更强调能力的考查。


科目:高中化学 来源: 题型:
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 25℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com