
| A. | 和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3 4.48L | |
| B. | 通入 H2S 气体,发生反应的离子方程式为:H2S+Fe2+=FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | Cl-、H+、I-、Na+不能在该溶液中大量共存 |
分析 A.含铵根离子为1L×0.1mol/L×2=0.2mol;
B.FeS可溶于盐酸;
C.酸性溶液中,离子之间发生氧化还原反应;
D.该组离子之间不反应.
解答 解:A.含铵根离子为1L×0.1mol/L×2=0.2mol,由N原子守恒可知,和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3为0.2mol×22.4L/mol=4.48L,故A正确;
B.FeS可溶于盐酸,则通入 H2S 气体,不发生反应,故B错误;
C.酸性溶液中,H+、ClO-、Cl-发生氧化还原反应,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原及酸性判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
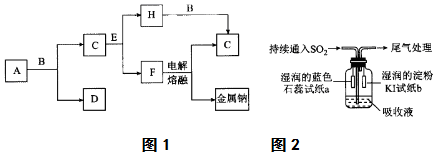
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O═4OH- | |
| C. | 将地下钢管与直流电源的正极相连,用来保护钢管 | |
| D. | 氢氧燃料电池中,氢气在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
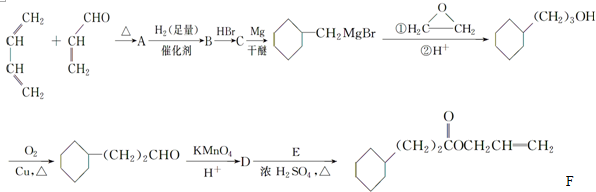
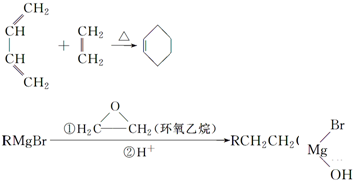

 .
. .
.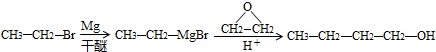 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com