
| c(H+)?c(A-) |
| c(HA) |
| c(H+)?c(A-) |
| c(HA) |
| 10-3×10-3 |
| 0.02 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、光化学烟雾的主要成分为氮的氧化物和碳氢化合物 |
| B、工业上可以从石油裂解气中获得乙烯 |
C、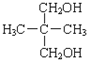 和 和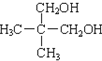 互为同分异构体 互为同分异构体 |
D、按系统命名法,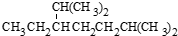 的名称为2,6-二甲基-3-乙基庚烷 的名称为2,6-二甲基-3-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
A.蒸馏 B.分液 C.盐析、过滤 |
① | ||
| ②乙醇(水) | ② | ||||
| ③肥皂(甘油、水) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
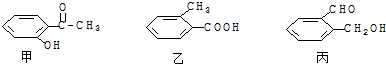
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,1L庚烷所含有的分子数为
| ||
| B、1mol甲基(-CH3)所含电子数为9NA | ||
| C、标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数为16NA | ||
| D、26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com