
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,MnO2发生还原反应 |
| B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.电池工作时,K+移向负极 |
| D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
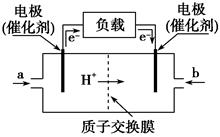
| A.右边的电极为电池的负极,b处通入的是空气 |
| B.左边的电极为电池的负极,a处通入的是甲醇 |
| C.电池负极的反应式为:2CH3OH+2H2O-12e-===2CO2↑+12H+ |
| D.电池正极的反应式为:3O2+12H++12e-===6H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
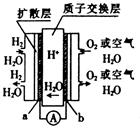
| A.a极为该电池的负极 |
| B.该电池的正极反应式为O2 + 4H+ + 4e-=2H2O |
| C.该电池的能量转化主要形式是化学能转化为电能 |
| D.H+(质子)由正极移动至负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.干电池中锌为正极,碳为负极 |
| B.干电池工作时,电流由锌极经外电路流向碳极 |
| C.干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器 |
| D.干电池可实现化学能向电能的转化和电能向化学能的转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
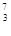 Li的质量是 g。
Li的质量是 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.牺牲阴极的阳极保护法是应用电解原理防止金属的腐蚀 |
| B.CO的标准燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+566.0 kJ·mol-1 |
| C.一个反应能否自发进行取决于该反应是放热还是吸热 |
| D.用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com